强生(JNJ)旗下杨森制药近日宣布,美国食品和药物管理局(FDA)已批准Darzalex(daratumumab)与Kyprolis(carfilzomib,卡非佐米)和地塞米松联合用药方案(DKd),用于治疗先前已接受过1-3种疗法的复发或难治性多发性骨髓瘤(R/R MM)成人患者。
这是首次批准将一款CD38抗体药物与Kyprolis(蛋白酶体抑制剂)联合用药。Darzalex被批准与2种Kyprolis给药方案相结合(每周一次70mg/m2,每周2次56mg/m2),该批准基于III期CANDOR研究和Ib期EQUULEUS研究的阳性结果。
CANDOR是一项随机、开发性III期研究,作为强生与安进合作的一部分开展,研究由安进赞助,由杨森研发公司共同资助。该研究入组了466例既往已接受1-3种疗法的R/R MM患者,评估了KdD方案相对于Kyprolis与地塞米松二药方案(Kd)的疗效和安全性。研究中,第一组(DKd)患者接受Kyprolis(每周2次56mg/m2)和地塞米松及Darzalex治疗,第二组(Kd组)接受Kyprolis(每周2次56mg/m2)和地塞米松治疗,所有患者接受治疗直至疾病进展。研究主要终点是无进展生存期(PFS),次要终点包括总缓解率(ORR)、微小残留病(MRD)、总生存期(OS)。PFS定义为随机化时间直至疾病进展或全因死亡。
该研究的结果在2019年美国血液学会(ASH)年会上公布。数据显示,在DKd组和Kd组分别进行了16.9个月和16.3个月的中位随访后,研究达到了PFS主要终点:DKd组中位PFS尚未达到,而Kd组中位PFS为15.8个月。与Kd组相比,DKd组疾病进展或死亡风险显著降低37%(HR=0.630;95%CI:0.464-0.854;p=0.0014)。除了达到主要终点外,与Kd相比,DKd在关键次要终点方面也表现出显著疗效,包括:ORR(84.3% vs 74.7%,p=0.0040)、治疗第12个月时的MRD阴性-完全缓解率(12.5% vs 1.3%,提高近10倍,p<0.0001)、OS(2组中位数均未达到,HR=0.75;95%CI:0.49,1.13;p=0.08)。研究中,DKd方案的安全性与方案中Darzalex和Kd已知的安全性一致。与Kd组相比,DKd组最常见的严重不良事件是肺炎(14% vs 9%)。致死性不良事件发生在10%的DKd患者和5%的Kd患者中,最常见的致命不良事件是感染(5% vs 3%)。
CANDOR研究(NCT03158688)是第一个将2种关键作用机制的药物Darzalex(抗CD38单抗)和Kyprolis(蛋白酶体抑制剂)进行联合用药治疗多发性骨髓瘤(MM)的III期研究。结果显示,与Kd方案(Kyprolis+地塞米松)相比,DKd方案(Darzalex+Kyprolis+地塞米松)显著延长了无进展生存期(中位PFS:未达到 vs 15.8个月)、将疾病进展或死亡风险显著降低37%。此外,将每周一次Kyprolis纳入批准的DKd方案,得到了开放标签、多队列Ib期EQUULEUS研究阳性结果的支持。该试验评估了Darzalex与多种治疗方案联合用药。
杨森研发公司后期开发和全球医疗事务副总裁Craig Tendler医学博士表示:“随着DKd方案的最新批准,多发性骨髓瘤患者现在可以选择在首次复发时接受Darzalex和Kyprolis治疗,这是他们治疗过程中的关键时刻。随着我们对疾病的深入关注,并致力于开发有助于改善复发性多发性骨髓瘤患者预后的方案,CANDOR研究进一步建立了另一种含有Darzalex的方案(DKd),它将为这些患者群体带来治疗益处。”
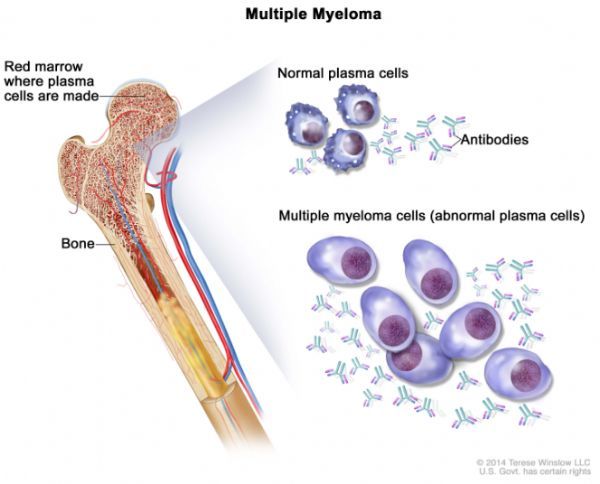
多发性骨髓瘤(图片来自:cancer.gov)
Darzalex于2015年11月首次获批上市,该药是全球获批的首个CD38介导性、溶细胞性抗体药物,具有广谱杀伤活性,可靶向结合多发性骨髓瘤及多种实体瘤细胞表面高度表达的跨膜胞外酶CD38分子,通过多种免疫介导的作用机制诱导肿瘤细胞的快速死亡,包括互补依赖性细胞毒作用(CDC)、抗体依赖性细胞介导的细胞毒作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP)以及通过细胞凋亡(apoptosis)。此外,Darzalex也已被证明能够靶向肿瘤微环境中的免疫抑制细胞从而表现出免疫调节活性。
Kyprolis于2012年7月首次获批上市,该药是一种静脉给药的不可逆蛋白酶体抑制剂。蛋白酶体在细胞功能和生长过程中发挥重要作用,可降解受损或不再需要的蛋白质。Kyprolis已被证明能够阻断蛋白酶体,导致蛋白质在细胞内过量聚集。在一些细胞中,Kyprolis可引起细胞死亡,尤其是多发性骨髓瘤细胞,这是由于这类细胞更可能含有较高量的异常蛋白质。
目前,Darzalex和Kyprolis已成为治疗多发性骨髓瘤(MM)的重要基础疗法。来自CANDOR研究的结果提供了强有力的证据,显示KdD方案治疗复发性疾病患者具有深度和持久的缓解。将Kypropris(蛋白酶体抑制剂)和Darzalex(抗CD38单抗)这两种强效靶向药物进行联合用药,代表了治疗复发或难治性多发性骨髓瘤患者的一种非常有潜力的新方法。
扩展阅读:
多发性骨髓瘤(MM)是一种无法治愈的血液系统恶性肿瘤,其特征为缓解和复发反复循环。该病是一种极具侵袭性的疾病,影响骨髓中的浆细胞,这些受影响的浆细胞会取代骨髓中的正常细胞。据估计,在2020年,将有32270人被确诊,12830人死于该病。虽然部分MM患者没有症状,但大多数患者是因为相关症状被确诊,这些症状包括骨折或疼痛、低红细胞计数、疲劳、高钙水平、肾脏问题或感染。
原文出处:U.S. FDA approves New DARZALEX® (daratumumab)-Based Combination Regimen for Patients with Relapsed/Refractory Multiple Myeloma
以上是关于(美国FDA批准Darzalex+Kyprolis+地塞米松三药方案(DKd),用于治疗多发性骨髓瘤)的最新资讯,如需了解Darzalex,Kyprolis更多资讯,可以直接联系我们药师客服。
以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。