艾伯维(AbbVie)近日宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,建议批准首创、口服、选择性B细胞淋巴瘤因子-2(BCL-2)抑制剂Venclyxto(venetoclax)联合低甲基化剂,用于治疗新诊断的、没有资格接受强化化疗的急性髓性白血病(AML)成人患者。现在,CHMP的意见将递交至欧盟委员会(EC)审查,后者预计在未来2个月做出最终审查决定。
CHMP的积极意见代表了第3个扩展Venclexta适应症的意见,是为欧洲患有AML这种毁灭性疾病的患者群体提供新治疗方案的关键一步。Venclexta联合低甲基化剂方案,将对现有的治疗方案提供有意义的改进,特别是对于那些预后通常很差的老年AML患者,这类患者常常因年龄和合并症不能接受强化化疗。
CHMP的积极审查意见,基于双盲、安慰剂对照3期研究VIALE-A(M15-656)以及开放标签、非随机、多中心1b期研究M14-358的结果。
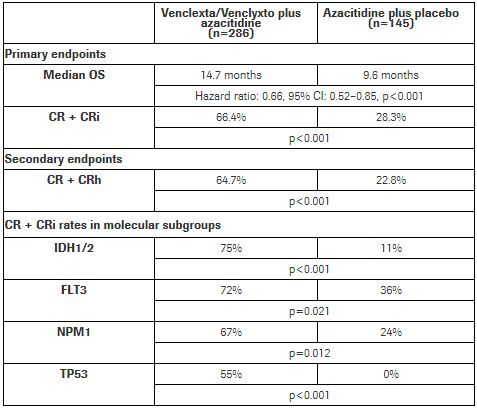
VIALE-A研究在新诊断的、没有资格接受强化化疗的AML成人患者中开展,比较了安慰剂+阿扎胞苷(AZA,一种低甲基化剂)方案、venetoclax+阿扎胞苷方案的疗效和安全性。结果显示,该研究达到了主要和次要终点:与安慰剂+阿扎胞苷相比,venetoclax+阿扎胞苷方案显著延长了总生存期(OS)、大幅提高了完全缓解率和血液学未完全恢复的完全缓解率(CR/CRi)。
具体数据为:(1)与阿扎胞苷+安慰剂组相比,venetoclax+阿扎胞苷治疗组OS显著延长(中位OS:14.7个月 vs 9.6个月)、死亡风险降低34%(HR=0.66;95%CI:0.52-0.85;p<0.001)。(2)与阿扎胞苷+安慰剂组相比,venetoclax+阿扎胞苷治疗组复合完全缓解率(CR+CRi)高出一倍多(66.4% vs 28.3%,p<0.001)。(3)该研究也达到了CR+CRh(完全缓解+部分血液学恢复的完全缓解)次要终点:venetoclax+阿扎胞苷治疗组CR+CRh为64.7%,阿扎胞苷+安慰剂组为22.8%。(4)安全性方面,该研究中,venetoclax联合阿扎胞苷的安全性与2种药物的已知副作用一致,不良事件(AE)与老年AML人群的预期一致;2个治疗组在生活质量方面没有差异。venetoclax联合阿扎胞苷组、安慰剂联合阿扎胞苷组最常报告的严重不良事件是发热性中性粒细胞减少(30%和10%)、肺炎(17%和22%)、败血症(6%和8%)和出血(9%和6%)。
VIALE-A研究数据
M14-358研究评估了venetoclax联合阿扎胞苷或地西他滨治疗新诊断的AML患者的疗效。结果显示:
——venetoclax联合阿扎胞苷治疗的患者:CR率为44%、CR+CRi率为71%;从启动治疗至达到首次CR或CRi的中位时间为1.2个月(范围:0.7个月-7.7个月);在达到CR或CRi的患者中,中位缓解持续时间(DOR)为21.9个月;最常报告的严重不良事件是发热性中性粒细胞减少(31%)和肺炎(26%)。
——venetoclax联合地西他滨治疗的患者:CR率为55%、CR+CRi率为74%;从启动治疗至达到首次CR或CRi的中位时间为1.9个月(范围:0.9个月-5.4个月);在达到CR或CRi的患者中,中位缓解持续时间(DOR)为15个月;最常报告的严重不良事件是发热性中性粒细胞减少(42%)、肺炎(29%)、菌血症(16%)和败血症(6%)。
关于Venclexta/Venclyxto
在美国,venetoclax(商品名:Venclexta)于2020年10月获得FDA批准,联合低甲基化剂(阿扎胞苷[azacitidine,AZA]或地西他滨[decitabine,DAC])或低剂量阿糖胞苷(LDAC),一线治疗新诊断的2类AML成人患者,具体为:(1)年龄≥75岁的老年AML患者;(2)因合并症而排除使用强化诱导化疗的AML成人患者。在美国,Venclexta于2018年获得FDA加速批准用于上述适应症。此次批准将Venclexta上述适应症由加速批准转为了完全批准。
截至目前,Venclexta/Venclyxto已获全球80多个国家批准上市,用于成人治疗慢性淋巴细胞白血病(CLL)、小细胞淋巴瘤(SLL)、急性髓性白血病(AML)
原文出处:AbbVie Receives Positive CHMP Opinion for VENCLYXTO® (venetoclax) as a Combination Regimen for Adult Patients with Newly Diagnosed Acute Myeloid Leukemia Who Are Ineligible for Intensive Chemotherapy
以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。