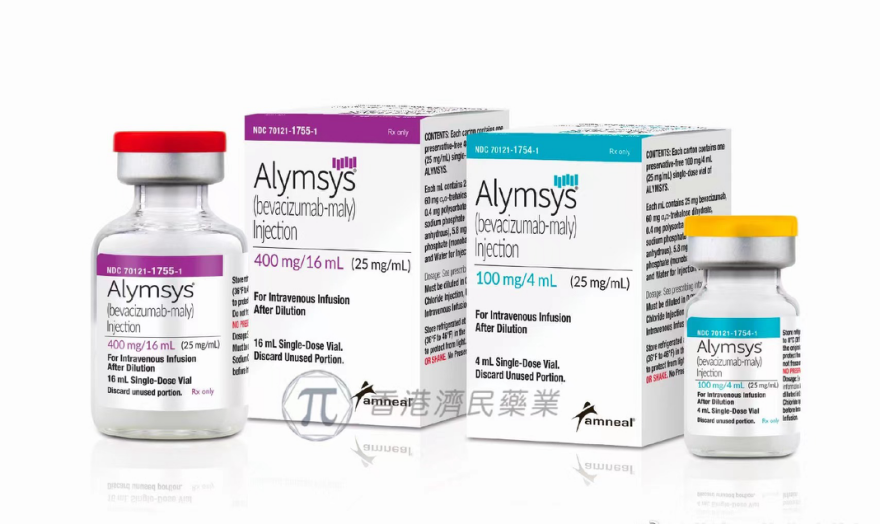
2021年4月13日,Amneal制药公司宣布美国食品药品监督管理局(FDA)已批准该公司关于Alymsys (bevacizumab-maly,贝伐单抗-maly)的生物制剂许可申请(BLA),这是一种与Avastin类似的生物仿制药。Alymsys是美国批准的第三个贝伐单抗生物仿制药。
Alymsys由mAbxience公司开发,这是一种用于肿瘤学的血管内皮生长因子抑制剂。这标志着Amneal预计今年将获得的肿瘤学领域(美国第二大生物仿制药类别)三项生物仿制药批准中的第二项。
Alymsys 不适用于结肠癌的辅助治疗。 在2项随机、开放标签、多中心临床研究中确定贝伐单抗作为结肠癌辅助治疗的标准化疗的辅助手段缺乏疗效。
【生产企业】Amneal Pharmaceuticals,Inc.
【规格】100 mg/4 mL (25 mg/mL)或400 mg/16 mL (25 mg/mL)
【商标】Alymsys
【通用名】bevacizumab-maly injection
【贮藏】在2℃至8℃温度下冷藏在原纸箱中,直至使用时避光保存。请勿冷冻或摇晃药瓶或纸盒。
【Alymsys(贝伐单抗-maly)适应症】
1.转移性结肠直肠癌
Alymsys联合静脉注射氟尿嘧啶为基础联合化疗,适用于转移性结直肠癌(mCRC)患者的一线或二线治疗。
Alymsys联合氟嘧啶-伊立替康或氟嘧啶-奥沙利铂为基础的化疗,适用于在一线含贝伐单抗产品方案中取得进展的mCRC患者的二线治疗。
Ø 使用限制
Alymsys不适合用于结肠癌的辅助治疗。
2.一线非鳞状非小细胞肺癌
Alymsys联合卡铂和紫杉醇适用于不可切除、局部晚期、复发或转移性非鳞状非小细胞肺癌(NSCLC)患者的一线治疗。
3.复发性胶质母细胞瘤
Alymsys适用于治疗成人复发性胶质母细胞瘤(GBM)。
4.转移性肾细胞癌
Alymsys与干扰素α联合用于治疗转移性肾细胞癌(mRCC)。
5.持续性、复发性或转移性宫颈癌
Alymsys与紫杉醇和顺铂或紫杉醇和拓扑替康联合用于治疗持续性、复发性或转移性宫颈癌患者。
6.上皮性卵巢癌、输卵管癌或原发性腹膜癌
Alymsys与紫杉醇、聚乙二醇化脂质体阿霉素或拓扑替康联合用于治疗铂类耐药的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌患者,这些患者之前接受的化疗方案不超过2个。
【Alymsys(贝伐单抗-maly)推荐剂量和给药方法】
1.重要的使用信息
择期手术前至少停药28天。在大手术后至少28天和伤口完全愈合之前,不要使用Alymsys。
Ø 转移性结肠直肠癌
当Alymsys联合静脉注射氟尿嘧啶为基础的化疗时,推荐剂量为:
每2周静脉注射5 mg/kg,与bolus-IFL联用。
每2周静脉注射10 mg/kg,与FOLFOX4联合使用。
每2周静脉注射5 mg/kg或每3周静脉注射7.5 mg/kg,与氟嘧啶-伊立替康或氟嘧啶-奥沙利铂为基础的化疗联合,用于一线含贝伐单抗产品方案进展的患者。
Ø 一线非鳞状非小细胞肺癌
推荐剂量为每3周静脉注射15 mg/kg,与卡铂和紫杉醇联合使用。
Ø 复发性胶质母细胞瘤
推荐剂量为每2周静脉注射10 mg/kg。
Ø 转移性肾细胞癌
建议剂量为10 mg/kg,每2周静脉注射一次,与干扰素α联合使用。
Ø 持续性、复发性或转移性宫颈癌
建议剂量为每3周15 mg/kg静脉注射,与紫杉醇和顺铂联合或与紫杉醇和拓扑替康联合。
Ø 上皮性卵巢癌、输卵管癌或原发性腹膜癌
复发性疾病
铂耐药
推荐剂量为每2周10 mg/kg静脉注射,与紫杉醇、聚乙二醇化脂质体阿霉素或拓扑替康联合使用(每周一次)。
推荐剂量为每3周静脉注射15 mg/kg,与拓扑替康联合使用(每3周一次)。
2.不良反应的剂量调整
表1描述了针对特定不良反应的剂量调整。不建议减少Alymsys的剂量。
表1:针对不良反应的剂量调整
|
不良反应 |
严重程度 |
调整 |
|
胃肠穿孔和瘘管 |
Ÿ 胃肠穿孔,任何级别
Ÿ 气管食管瘘,任何等级
Ÿ 瘘管,4级
Ÿ 涉及任何内部器官的瘘管形成 |
停止使用Alymsys |
|
伤口愈合并发症 |
任何 |
在伤口完全愈合之前,不要使用Alymsys。伤口愈合并发症解决后恢复贝伐单抗产品的安全性尚未确定。 |
|
坏死性筋膜炎 |
停止使用Alymsys |
|
出血 |
3或4级 |
停止使用Alymsys |
|
最近有一次咯血史,咯血量为1茶匙(2.5 mL)或以上 |
暂停使用Alymsys |
|
血栓栓塞事件 |
动脉血栓栓塞,严重 |
停止使用Alymsys |
|
静脉血栓栓塞,4级 |
停止使用Alymsys |
|
高血压 |
Ÿ 高血压危象
Ÿ 高血压脑病 |
停止使用Alymsys |
|
高血压,严重 |
如果医疗管理未能控制,则暂停Alymsys;控制后恢复 |
|
后部可逆性脑病综合征(PRES) |
任何 |
停止使用Alymsys |
|
肾病综合征 |
停止使用Alymsys |
|
肾损伤和蛋白尿 |
在没有肾病综合征的情况下,蛋白尿大于或等于每24小时2克 |
中止Alymsys,直至蛋白尿低于每24小时2克 |
|
严重 |
停止使用Alymsys |
|
与输液相关的反应 |
具有临床意义
|
中断输液;症状消失后,以较低的速度恢复输液 |
|
轻度,临床无意义 |
降低输注速度 |
|
充血性心力衰竭 |
任何 |
停止使用Alymsys |
3.制备和给药
4.准备
Ø 使用适当的无菌技术。
Ø 在准备给药前,目视检查药瓶是否有颗粒物质和变色。如果溶液浑浊、变色或含有颗粒物质,则丢弃小瓶。
Ø 取出必要量的Alymsys,并稀释至总体积为100 mL的0.9%氯化钠注射液。请勿使用或与葡萄糖溶液混合。
Ø 丢弃小瓶中剩余的未使用部分,因为本产品不含防腐剂。
Ø 将稀释的Alymsys溶液在2℃至8℃温度下储存4小时。
Ø 未观察到Alymsys与聚氯乙烯或聚烯烃袋之间的不相容性。
5.使用
Ø 作为静脉输液给药。
Ø 首次输液:输液90分钟以上。
Ø 后续输注:如果耐受首次输注,则在60分钟内进行第二次输注。如果耐受超过60分钟的第二次输注,则在30分钟内进行所有后续输注。
【Alymsys(贝伐单抗-maly)药物相互作用】
Alymsys对其他药物的影响
当贝伐单抗与伊立替康或其活性代谢物SN38、干扰素α、卡铂或紫杉醇联合给药时,未观察到对这些药物的药代动力学有临床意义的影响;然而,在接受贝伐单抗联合紫杉醇和卡铂治疗的8名患者中,有3名患者在4个治疗周期后(第63天)的紫杉醇暴露量低于第0天,而单独接受紫杉醇和卡铂治疗的患者在第63天的紫杉醇暴露量高于第0天。
【Alymsys(贝伐单抗-maly)的警告和注意事项】
1.胃肠穿孔和瘘管
与接受化疗的患者相比,接受贝伐单抗产品的患者发生严重、有时致命的胃肠穿孔的发生率更高。在临床研究中,发病率从0.3%到3%不等,在有盆腔放疗史的患者中发病率最高。穿孔可能会因腹内脓肿、瘘管形成和需要进行造口术而变得复杂。大多数穿孔发生在首次给药后50天内。
与接受化疗的患者相比,接受贝伐单抗产品的患者发生严重瘘管(包括气管食管、支气管胸膜、胆道、阴道、肾脏和膀胱部位)的几率更高。在临床研究中,发病率从< 1%到1.8%不等,宫颈癌患者发病率最高。大多数瘘管发生在第一次给药后的6个月内。患有胃肠道阴道瘘的患者也可能患有肠梗阻,并需要外科手术以及转向造口术。
对于通过盆腔检查或CT扫描发现直肠乙状结肠受累或有肠梗阻临床症状的卵巢癌患者,应避免使用Alymsys。出现胃肠穿孔、气管食管瘘或任何4级瘘的患者应停止用药。出现涉及任何内部器官的瘘管形成的患者应停止用药。
2.手术和伤口愈合并发症
在一项对照临床研究中,贝伐单抗未在大手术后28天内给药,在接受贝伐单抗治疗的mCRC患者中,伤口愈合并发症(包括严重和致命并发症)的发生率为15%,在未接受贝伐单抗治疗的患者中为4%。在一项针对复发或复发性GBM患者的临床对照研究中,接受贝伐单抗治疗的患者伤口愈合事件的发生率为5%,未接受贝伐单抗治疗的患者为0.7%。
在Alymsys治疗期间出现伤口愈合并发症的患者,应停用Alymsys,直到伤口完全愈合。择期手术前至少停药28天。大手术后至少28天内不要使用,直到伤口完全愈合。伤口愈合并发症解决后恢复贝伐单抗产品的安全性尚未确定。
据报道,接受贝伐单抗治疗的患者出现坏死性筋膜炎,包括致命病例,通常继发于伤口愈合并发症、胃肠穿孔或瘘管形成。出现坏死性筋膜炎的患者应停止使用Alymsys。
3.出血
贝伐单抗产品可导致两种不同类型的出血:轻微出血,最常见的是1级鼻出血,以及严重出血,在某些情况下是致命的。与仅接受化疗的患者相比,接受贝伐单抗治疗的患者发生严重或致命性出血(包括咯血、消化道出血、呕血、中枢神经系统出血、鼻出血和阴道出血)的频率高达5倍。在所有临床研究中,接受贝伐单抗治疗的患者中,3至5级出血事件的发生率为0.4%至7%。
接受贝伐单抗联合化疗的鳞状非小细胞肺癌患者中有31%发生严重或致命性肺出血,而接受单纯化疗的非鳞状非小细胞肺癌患者中有4%发生严重或致命性肺出血。
对于近期咳血1茶匙或更多的患者,不要使用Alymsys。出现3-4级出血的患者应停止用药。
4.动脉血栓栓塞事件
接受贝伐单抗治疗的患者发生脑梗死、短暂性脑缺血发作、心肌梗死和心绞痛等严重(有时致命)动脉血栓栓塞事件(ATE)的发生率高于接受化疗的患者。在所有临床研究中,接受贝伐单抗联合化疗的患者中3 - 5级ATE的发生率为5%,而单独接受化疗的患者中该发生率≤2%;发病率最高的是GBM患者。有动脉血栓栓塞史、糖尿病或> 65岁的患者发生ATE的风险增加。
在出现严重ATE的患者中停用。ATE消退后重新启动贝伐单抗产品的安全性尚不清楚。
5.静脉血栓栓塞事件
临床研究中观察到静脉血栓栓塞事件的风险增加(VTE)。在研究GOG-0240中,11%接受贝伐单抗联合化疗的患者发生3至4级VTE病,而单独接受化疗的患者发生率为5%。在EORTC 26101中,接受贝伐单抗联合化疗的患者中3至4级VTE病的发生率为5%,而单独接受化疗的患者中为2%。
对于患有4级VTE(包括肺栓塞)的患者,停用Alymsys。
6.高血压
与单独接受化疗的患者相比,接受贝伐单抗产品治疗的患者发生严重高血压的发生率更高。在所有临床研究中,3 - 4级高血压的发生率在5%至18%之间。
在使用Alymsys治疗期间,每两到三周监测一次血压。采用适当的降压治疗,并定期监测血压。在使用Alymsys诱导或加重的高血压患者停用Alymsys后,继续定期监测血压。对于未通过医疗管理进行控制的重度高血压患者,暂停使用Alymsys;经医疗管理控制后立即恢复使用。对出现高血压危象或高血压脑病的患者停止使用Alymsys。
7.后部可逆性脑病综合征
在所有临床研究中,报告后可逆脑病综合征(PRES)的患者< 0.5%。首次给药后16小时至1年出现症状。PRES是一种神经系统疾病,可表现为头痛、癫痫、嗜睡、意识错乱、失明和其他视觉和神经系统障碍。可能存在轻度至重度高血压。磁共振成像是确认PRES诊断的必要手段。
在出现PRES的患者中停用Alymsys。症状通常在停用贝伐单抗产品后数天内消退或改善,尽管一些患者经历了持续的神经系统后遗症。在发生PRES的患者中重新开始使用贝伐单抗产品的安全性尚不清楚。
8.肾损伤和蛋白尿
与接受化疗的患者相比,接受贝伐单抗的患者蛋白尿的发生率和严重程度更高。在临床研究中,3级(定义为尿试纸4+或每24小时蛋白质> 3.5克)至4级(定义为肾病综合征)的范围为0.7%至7%。蛋白尿的总体发生率(所有级别)仅在研究BO17705中得到充分评估,其发生率为20%。开始使用贝伐单抗后,蛋白尿的中位发作时间为5.6个月(15天至37个月)。中位解决时间为6.1个月(95%可信区间:2.8,11.3)。经过11.2个月的中位随访,40%的患者蛋白尿没有消退,30%出现蛋白尿的患者需要停用贝伐单抗
在对七项随机临床研究的患者进行的探索性汇总分析中,接受贝伐单抗化疗的患者中有5%出现2 - 4级蛋白尿(定义为尿试纸2+或以上或每24小时蛋白> 1克或肾病综合征)。74%的患者出现2-4级蛋白尿。42%的患者重新开始服用贝伐单抗。在113名重新接受贝伐单抗治疗的患者中,48%的患者再次出现2-4级蛋白尿。
在所有临床研究中,接受贝伐单抗治疗的患者中肾病综合征的发生率低于1%,在某些情况下会导致死亡。在一个已发表的病例系列中,6例蛋白尿患者的肾活检结果显示与血栓性微血管病一致。对接受贝伐单抗联合化疗的5805名患者和接受单纯化疗的3713名患者进行回顾性分析的结果显示,接受贝伐单抗的患者血清肌酐水平升高的比率更高(基线水平的1.5至1.9倍之间)。大约三分之一接受贝伐单抗治疗的患者的血清肌酐水平没有恢复到基线水平。
在Alymsys治疗期间,通过尿液试纸分析监测蛋白尿的发展或恶化。尿液试纸读数为2+或更高的患者应接受24小时尿液收集的进一步评估。对于每24小时尿蛋白量大于或等于2克的患者停止用药,当每24小时尿蛋白量小于2克时继续用药。发展为肾病综合征的患者应停止用药。
一项上市后安全性研究的数据显示,UPCR(尿蛋白/肌酐比)和24小时尿蛋白之间相关性较差[皮尔逊相关系数0.39 (95% CI: 0.17,0.57)]。
9.输液相关反应
临床研究和上市后经验中报告的输注相关反应包括高血压、与神经系统体征和症状相关的高血压危象、喘息、氧饱和度降低、3级超敏反应、胸痛、头痛、寒战和发汗。在临床研究中,首剂药物的输注相关反应发生在< 3%的患者中,严重反应发生在0.4%的患者中。
对于轻微的、临床上不明显的输注相关反应,降低输注速率。对于出现临床上显著的输注相关反应的患者,应中断输注,并考虑在问题解决后以较慢的速率恢复输注。出现严重输注相关反应的患者应停止用药,并给予适当的药物治疗(例如,肾上腺素、皮质类固醇、静脉注射抗组胺药、支气管扩张剂和/或氧气)。
10.胚胎-胎儿毒性
根据其作用机制和动物研究结果,贝伐单抗产品在用于孕妇时可能会对胎儿造成伤害。在器官形成期间,每隔3天以低至10 mg/kg的临床剂量给怀孕兔子施用贝伐单抗,观察到先天畸形。此外,动物模型将血管生成和VEGF和VEGFR2与女性生殖、胚胎-胎儿发育和产后发育的关键方面联系起来。告知孕妇对胎儿的潜在风险。建议具有生殖潜力的女性在接受Alymsys治疗期间以及最后一次给药后的6个月内使用有效的避孕措施。
11.卵巢衰竭
在接受贝伐单抗联合化疗的绝经前妇女中,卵巢衰竭的发生率为34%,而在接受单纯化疗辅助治疗实体瘤的绝经前妇女中,卵巢衰竭的发生率为2%。在停止贝伐单抗治疗后,22%接受贝伐单抗治疗的女性在治疗后的所有时间点卵巢功能均有恢复。卵巢功能的恢复定义为月经恢复、血清β-HCG妊娠试验阳性或治疗后FSH水平< 30 mIU/mL。贝伐单抗产品对生育能力的长期影响尚不清楚。在开始使用Alymsys之前,告知女性卵巢衰竭风险的生殖潜力。
12.充血性心力衰竭(CHF)
Alymsys不适用于蒽环类药物为基础的化疗。接受贝伐单抗治疗的患者中,左心室功能≥ 3级的发生率为1%,相比之下,接受单纯化疗的患者为0.6%。在既往接受过蒽环类药物治疗的患者中,接受贝伐单抗联合化疗的患者的CHF发生率为4%,而仅接受化疗的患者为0.6%。
在以前未经治疗的血液系统恶性肿瘤患者中,接受贝伐单抗联合蒽环类药物化疗的患者与接受安慰剂联合相同化疗方案的患者相比,充血性心力衰竭的发生率和左心室射血分数(LVEF)的下降率增加。在接受贝伐单抗联合化疗的患者中,LVEF从基线下降≥ 20%或从基线下降10%至< 50%的患者比例为10%,而在接受单独化疗的患者中为5%。至少85%的患者在首次给药后1至6个月出现左心室功能障碍或CHF,在贝伐单抗组中,62%的CHF患者得到缓解,而在安慰剂组中为82%。发展为充血性心力衰竭的患者应停止使用Alymsys。
【Alymsys(贝伐单抗-maly)不良反应】
1. Alymsys可能会引起严重的副作用,包括: 荨麻疹,呼吸困难,面部、嘴唇、舌头或喉咙肿胀,头晕,头晕目眩,呼吸急促,寒战,出汗,头疼,胸痛,喘息,容易擦伤,异常出血(鼻、口、阴道、直肠),任何无法停止的流血,剧烈的胃痛,血便或柏油样大便,咳血,看起来像咖啡渣的呕吐物,突然的麻木或虚弱(特别是身体的一侧),突然剧烈头痛,视力或平衡有问题,极度虚弱或疲劳,头疼,视力问题,昏厥,癫痫发作,咽喉、肺、胆囊、肾脏、膀胱或阴道内的瘘管(异常通道),胃痛或肿胀,漏尿,吃东西或喝水的时候,你会感到窒息和作呕,一条或两条腿疼痛、肿胀、发热或发红,疼痛扩散到你的下巴或肩膀,月经失调,眼睛浮肿,脚踝或脚上肿胀,看起来像泡沫的尿液,体重快速增加,发烧,口腔溃疡,皮肤溃疡,咳嗽,皮肤突然发红,发热、肿胀或渗血,或任何无法愈合的皮肤伤口或手术切口,视力模糊和颈部或耳朵剧烈跳动。如果您有上述任何一种症状,请立即就医。
2.Alymsys最常见的副作用包括: 流鼻血,直肠出血,血压升高,头疼,背痛,眼睛干涩或流泪,皮肤干燥或易剥落,流鼻涕,打喷嚏和味觉的变化。如果您有任何困扰您或持续不断的副作用,请告诉医生。
3.这些并不是Alymsys所有可能的副作用。有关更多信息,请询问您的医生或药剂师。
【Alymsys(贝伐单抗-maly)在特殊人群中的使用】
1.妊娠
根据动物研究结果及其作用机制,贝伐单抗产品可能会对孕妇的胎儿造成伤害。有限的上市后报告描述了怀孕期间使用贝伐单抗产品导致胎儿畸形的病例;然而,这些报告不足以确定药物相关风险。在动物生殖研究中,在器官形成过程中,每隔3天对怀孕兔子静脉注射贝伐单抗(剂量约为10 mg/kg临床剂量的1至10倍),产生了胎儿吸收、母体和胎儿体重增加减少以及多种先天性畸形,包括角膜混浊、颅骨和骨骼异常骨化(包括四肢和指骨缺损)。此外,动物模型将血管生成、VEGF和VEGFR2与女性生殖、胚胎发育和产后发育的关键方面联系起来。告知孕妇对胎儿的潜在风险。
在美国普通人群中,临床认可的妊娠中主要出生缺陷和流产的估计背景风险分别为2%至4%和15%至20%。
2.哺乳期
没有关于母乳中存在贝伐单抗产品、对母乳喂养婴儿的影响或对产奶量的影响的数据。人类IgG存在于母乳中,但已发表的数据表明母乳抗体不会大量进入新生儿和婴儿循环。由于贝伐单抗产品可能对母乳喂养的婴儿产生严重的不良反应,建议女性在接受Alymsys治疗期间以及最后一次给药后的6个月内不要进行母乳喂养。
3.具有生殖潜力的女性和男性
Ø 避孕
女性
贝伐单抗产品在给孕妇使用时可能会对胎儿造成伤害。建议具有生殖潜力的女性在接受Alymsys治疗期间以及最后一次给药后的6个月内使用有效的避孕措施。
Ø 不孕
女性
贝伐单抗产品会增加卵巢衰竭的风险,并可能损害生育能力。在第一剂Alymsys之前,告知女性卵巢衰竭风险的生殖潜力。贝伐单抗产品对生育能力的长期影响尚不清楚。
在一项179名绝经前妇女的临床研究中,随机接受贝伐单抗联合或不联合化疗,接受贝伐单抗联合化疗的患者卵巢衰竭的发生率(34%)高于仅接受化疗的患者(2%)。在停止贝伐单抗化疗后,22%的患者出现卵巢功能恢复。
4.儿科使用
贝伐单抗产品在儿科患者中的安全性和有效性尚未确定。
在已发表的文献报道中,在接受贝伐单抗治疗的18岁以下患者中观察到非下颌骨骨坏死病例。贝伐单抗产品未被批准用于18岁以下的患者。
在接受贝伐单抗和伊立替康治疗的8名复发性GBM儿童患者中未观察到抗肿瘤活性。在两项随机临床研究中,一项是高级别神经胶质瘤(n= 121)研究,另一项是转移性横纹肌肉瘤或非横纹肌肉瘤软组织肉瘤(n= 154)研究,在标准治疗基础上增加贝伐单抗并没有提高儿童患者的无事件生存率。
基于对152名儿童和年轻成人癌症患者(7个月至21岁)数据的群体药代动力学分析,儿童中按体重标准化的贝伐单抗清除率与成人相当。
5.老年使用
在对来自5项随机对照研究的1,745名患者的探索性汇总分析中,35%的患者年龄≥65岁。无论年龄大小,所有接受贝伐单抗联合化疗的患者与仅接受化疗的患者相比,ATE的总体发生率增加;然而,与年龄< 65岁的患者(2%比1%)相比,年龄≥65岁的患者的ATE发病率增加更大(8%比3%)。
【Alymsys(贝伐单抗-maly)用药过量】
无有关信息。
【Alymsys(贝伐单抗-maly)禁忌症】
无
【Alymsys(贝伐单抗-maly)一般描述】
1.Bevacizumab-maly是一种血管内皮生长因子抑制剂。bevacizumab-maly是一种重组人源化单克隆IgG1抗体,包含人框架区和鼠互补决定区。bevacizumab-maly的分子量约为149 kDa。bevacizumab-maly在哺乳动物细胞(中国仓鼠卵巢)表达系统中产生。
2.Alymsys (bevacizumab-maly)注射液是一种无菌、不含防腐剂、澄清至微乳白色、无色至浅棕色的溶液,装在单剂量小瓶中,供静脉注射使用。Alymsys含有浓度为25 mg/mL的bevacizumab-maly,装在100 mg/4 mL或400 mg/16 mL的单剂量小瓶中。
3.每毫升溶液含有25毫克bevacizumab-maly、α,α-海藻糖二水合物(60毫克)、聚山梨醇酯20 (0.4毫克)、无水磷酸氢二钠(1.2毫克)、磷酸二氢钠一水合物(5.8毫克)和注射用水。pH值为6.2。
【Alymsys(贝伐单抗-maly)作用机制】
贝伐单抗产品结合VEGF,并阻止VEGF与其在内皮细胞表面的受体(Flt-1和KDR)的相互作用。在血管生成的体外模型中,VEGF与其受体的相互作用导致内皮细胞增殖和新血管形成。给裸鼠(无胸腺)结肠癌异种移植模型施用贝伐单抗导致微血管生长的减少和转移性疾病进展的抑制。
【Alymsys(贝伐单抗-maly)患者资讯资料】
1.胃肠穿孔和瘘管:贝伐单抗产品可能会增加胃肠道穿孔和瘘管的风险。建议患者在出现高烧、寒战、持续或严重腹痛、严重便秘或呕吐时立即就医。
2.手术和伤口愈合并发症:贝伐单抗产品会增加伤口愈合并发症的风险。在与医生讨论这一潜在风险之前,建议患者不要进行手术。
3.出血:贝伐单抗产品会增加出血的风险。建议患者在出现严重或异常出血(包括咳嗽或吐血)的迹象和症状时,立即就医。
4.动脉和静脉血栓栓塞事件:贝伐单抗产品会增加动脉和静脉血栓栓塞事件的风险。建议患者出现动脉或静脉血栓栓塞的体征和症状时立即就医。
5.高血压:贝伐单抗产品会增加血压。告知患者,他们将接受常规血压监测,如果出现血压变化,请联系医生。
6.后部可逆性脑白质病综合征:后部可逆性脑病综合征(PRES)与贝伐单抗产品治疗有关。建议患者在神经功能新发或恶化时立即就医。
7.肾损伤和蛋白尿:贝伐单抗产品会增加蛋白尿和肾损伤的风险,包括肾病综合征。告知患者,使用Alymsys治疗需要定期监测肾功能,在出现蛋白尿或肾病综合征的体征和症状时联系医生。
8.输液相关反应:贝伐单抗产品可引起输液相关反应。建议患者在出现输液相关反应的体征或症状时,立即就医。
9.充血性心力衰竭:贝伐单抗产品会增加发生充血性心力衰竭的风险。建议患者在出现充血性心力衰竭的体征和症状时立即就医。
10.胚胎-胎儿毒性:告知女性患者贝伐单抗产品可能会对胎儿造成伤害,并告知医生已知或疑似怀孕的情况。建议具有生殖潜力的女性在接受Alymsys治疗期间以及最后一次给药后的6个月内使用有效的避孕措施。
11.卵巢衰竭:贝伐单抗产品可能导致卵巢衰竭。在开始治疗前,告知患者可能的保存卵子的方案。
12.哺乳:建议女性在接受Alymsys治疗期间以及最后一次给药后的6个月内不要进行母乳喂养。
【Alymsys(贝伐单抗-maly)购买价格是多少?】
购买Alymsys(贝伐单抗-maly)具体是多少钱?请联系在线客服。
来源:
[1] https://www.drugs.com/newdrugs/fda-approves-alymsys-bevacizumab-maly-biosimilar-avastin-5819.html
[2] https://www.rxlist.com/alymsys-drug.htm
注:药品如有新包装,以新包装为准。以上资讯为高等医药院校的学生志愿者翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。