近日,ViiV Healthcare公司宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,建议批准Rukobia(fostemsavir)600mg缓释片,联合其他抗逆转录病毒(ARV)药物,用于治疗无法构建抑制性抗病毒方案的多重耐药HIV-1成人感染者。
Rukobia是一种治疗HIV-1感染的新型附着抑制剂。今年6月,Rukobia获得美国FDA批准,适应症为:联合其他ARV药物,用于治疗曾尝试过多种HIV疗法(heavily treatment-experienced,HTE)、并且由于耐药/不耐受或安全性的考虑而对其当前ARV方案治疗失败的多重耐药HIV-1成人感染者。
在关键III期BRIGHT研究中,大多数(60%)HTE多重耐药HIV-1成人感染者接受Rukobia和优化的背景治疗后,实现并维持病毒抑制直至96周,且CD4+T细胞技术有临床意义的改善。
CHMP的积极审查意见,基于在HTE多重耐药HIV患者中开展的关键III期BRIGHT研究(NCT02362503)的数据。该研究的96周结果于2019年7月在墨西哥城举办的2019国际艾滋病学会艾滋病科学会议(IAS 2019)上公布。
BRIGHT是一项2个队列(随机和非随机)研究,评估了HIV-1附着抑制剂fostemsavir在既往已过度治疗(HTE)的HIV-1成人感染者中的安全性和有效性。研究共入组了371例患者,这些患者尽管服用抗逆转录病毒(ARV)药物但血液中的病毒(HIV-RNA)水平仍然很高。大多数患者接受HIV治疗超过15年(71%)、在进入试验前曾接受过5种或更多种不同的HIV治疗方案(85%)和/或有艾滋病史(86%)。
所有患者均记录有对目前可用的6类ARV药物中的4类具有耐药性、不可耐受性和/或禁忌症。在随机队列(n=272)中,患者在基线时必须对1类但不超过2类ARV药物保持完全活性,并且不能从其剩余的药物中形成可行的ARV方案。这些患者以3:1的比例进行随机分配,在其当前失败的治疗方案中盲法加入fostemsavir或安慰剂(n=272),进行持续8天的功能性单药治疗。针对已批准ARV无任何剩余完全活性的患者(n=99)被分配进入非随机队列,并在第1天接受开放标签fostemsavir及优化的背景治疗(OBT)。研究的主要终点是随机队列log10 HIV-1 RNA在第1天与第8天之间的平均变化。在8天双盲期之后,随机队列所有患者接受开放标签fostemsavir和优化的背景治疗。关键的次要终点包括第24、48、96周反应的持久性,以及CD4+细胞技术从基线的安全变化和病毒耐药性的出现。
结果显示,根据随机队列中从第1天到第8天HIV-1 RNA经调整后的平均下降,主要终点分析显示fostemsavir优于安慰剂(分别下降0.79和0.17 log10 c/mL;p<0.0001,意向性治疗-暴露[ITT-E]人群)。在随机队列中,在这种难以治疗的多药耐药HIV-1患者群体中,病毒学抑制和免疫应答率从24周至96周继续增加。
具体数据:随机队列中接受fostemsavir与优化背景疗法(OBT)治疗的患者中,治疗第24、48周、96周实现病毒学抑制(HIV-1 RNA<40拷贝/毫升[c/ml])的患者比例分别为53%、54%、60%(n=163/272)。随时间推移,患者表现出持续的免疫改善,CD4+细胞计数的平均变化持续增加(第24周、48周、96周分别增加90个、139个、205个细胞/微升)
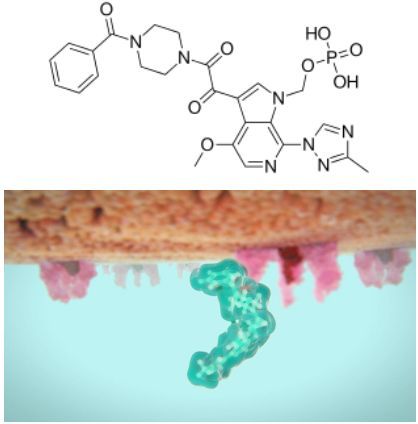 fostemsavir分子结构式
fostemsavir分子结构式
研究中,最常见的不良反应(≥5%,所有级别)是恶心和腹泻。至第96周,因不良事件而停止fostemsavir治疗的患者比例为7%(随机:5%,非随机:2%)。
Rukobia的批准上市,将为那些由于各种原因而无法用现有药物抑制和维持病毒抑制的HTE多重耐药HIV-1成人感染者,提供一个重要的治疗选择。此前,美国FDA已授予Rukobia快速通道资格、优先审查资格、突破性药物资格。欧盟EMA已授予Rukobia加速评估资格。
以上是关于(新型附着抑制剂Rukobia在欧盟即将获批:用于治疗无法构建抑制性抗病毒方案的多重耐药HIV-1成人感染者)的最新资讯,如需了解Rukobia更多资讯,可以直接联系我们药师客服。
以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。