Nexviazyme (avalglucosidase alfa-ngpt)注射剂中文说明书
2021年8月6日,美国食品药品监督管理局(FDA)批准赛诺菲(Sanofi)的Nexviazyme (avalglucosidase alfa-ngpt)注射剂,用于治疗1岁及以上晚发型庞贝氏症患者。庞贝氏症是一种进行性和衰弱性肌肉疾病,会损害人的运动和呼吸能力。Nexviazyme是一种酶替代疗法(ERT),旨在特异性靶向甘露糖-6-磷酸(M6P)受体,这是庞贝氏病中酶替代疗法的细胞摄取的关键途径。Nexviazyme已经在临床试验中被证明可以改善患者的呼吸功能和步行距离。
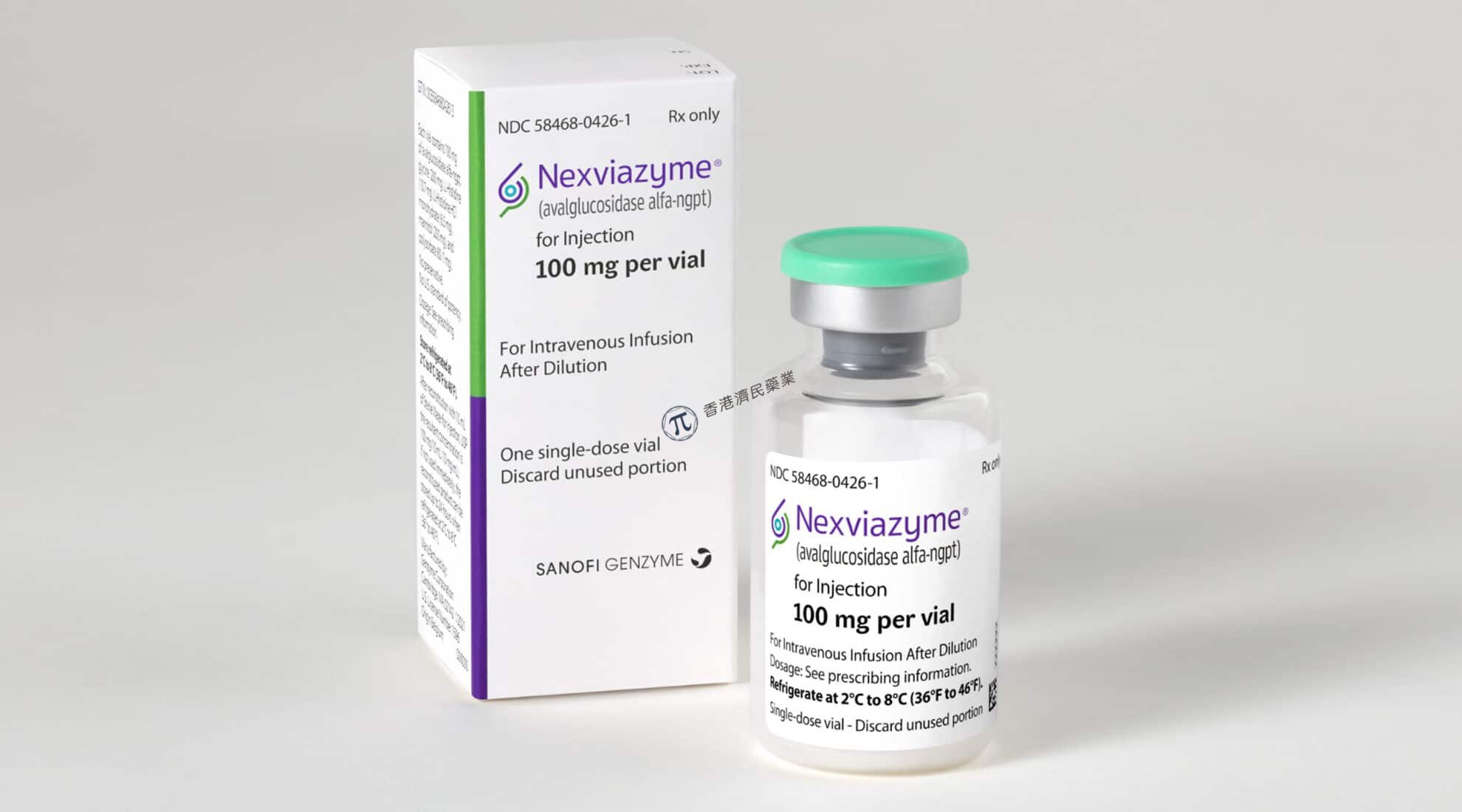
庞贝病是由溶酶体酶酸α-葡萄糖苷酶(GAA)遗传缺陷或功能障碍引起的,这导致全身肌肉细胞中糖原的积累。糖原的积累导致肌肉不可逆的损伤,包括支持呼吸功能的横膈膜和影响运动能力、功能耐力和呼吸的骨骼肌。
【生产企业】Sanofi
【规格】100mg/瓶,avalglucosidase alfa-ngpt为白色至淡黄色冻干粉,装于用于复溶的单剂量小瓶中。
【商标】Nexviazyme
【通用名】avalglucosidase alfa-ngpt for injection
【贮藏】将装有Nexviazyme的小瓶冷藏在2℃至8℃。请勿在药瓶上的有效期过后使用Nexviazyme
【Nexviazyme适应症】
Nexviazyme (avalglucosidase alfa-ngpt)是一种水解溶酶体糖原的特异性酶,用于治疗1岁及以上晚发型庞贝氏症(溶酶体酸α-葡糖苷酶[GAA]缺乏)的患者。
【Nexviazyme推荐剂量和给药方法】
一、推荐剂量及用法
Ÿ 在使用Nexviazyme之前,考虑使用抗组胺药、解热镇痛药和/或皮质类固醇。
Ÿ Nexviazyme必须在使用前重新配制和稀释。
Ÿ Nexviazyme以静脉输液形式给药。对于体重:
Ø ≥30 kg,建议剂量为每两周20 mg/kg(实际体重)
Ø < 30 kg,建议剂量为每两周40 mg/kg(实际体重)
Ÿ 初始建议输注速率为1mg/kg/小时。如果没有发生输注相关反应(IAR),则每30分钟逐渐增加输注速率。
二、由于超敏反应和/或输注相关反应导致的剂量和给药修改
Ÿ 如果发生严重超敏反应(包括过敏反应)或严重输液相关反应(IAR),立即停止使用Nexviazyme并开始适当的药物治疗。
Ÿ 如果出现轻度至中度超敏反应或中度IAR,考虑暂时停止或减慢输注速度,并开始适当的药物治疗。如果出现症状:
Ø 尽管暂时停止输液,但要坚持下去。至少要等待30分钟使症状缓解后再决定停止输液。
Ø 症状消退后,以发生反应的注射速率的一半继续输注30分钟,然后将输注速率增加50%,持续15分钟至30分钟。如果症状没有复发,则增加输注速率至反应发生的速率,并考虑之后以逐步增加速率的方式给药。
Ø 重构和稀释说明
按照以下方式重组和稀释Nexviazyme。准备过程中使用无菌技术。
Ÿ 重构冻干粉
1. 根据单个患者的体重和推荐剂量,确定配制需要使用的药瓶数量。
2. 从冰箱中取出所需数量的小瓶,放置约30分钟,使其达到室温。
3. 通过将10mL注射用无菌水缓慢滴加到小瓶内部,而不是直接滴加到冻干粉上,重新配制每个小瓶。轻轻倾斜和滚动每个小瓶。避免稀释剂对冻干粉的强力冲击,避免起泡。不要倒置、旋转或摇晃。让溶液溶解。重构后,每个小瓶将产生100mg/10mL(10mg/mL)的avalglucosidase alfa-ngpt。
4. 立即目视检查小瓶中的重构溶液是否有颗粒物质和变色。重新配制的溶液为清澈、无色至淡黄色。如果发现有颗粒或溶液变色,请勿使用。
Ÿ 重构溶液的储存
立即稀释重新配制的溶液。如果不能立即使用,复原的溶液可以在2℃至8℃的冰箱中保存24小时。不要冻结。
Ÿ 稀释重构溶液
1. 慢慢从每个小瓶中取出一定体积的重构溶液(根据患者的体重计算)。
2. 将重构溶液缓慢直接加入到5%葡萄糖注射液中。基于患者体重的建议总输注量见表1。避免输液袋起泡或搅动,避免空气进入输液袋。丢弃小瓶中剩余的任何未使用的重构溶液。
3. 轻轻翻转或按摩输液袋,混合输液袋的内容物。不要摇晃。稀释后,溶液的最终浓度为0.5至4mg/mL的avalglucosidase alfa-ngpt。
4. 立即使用稀释的溶液。建议输注时间为4至7小时。9小时后丢弃任何未使用的稀释溶液。
Ÿ 稀释溶液的储存
Ø 如果稀释后的溶液没有立即使用,可2℃至8°C的温度下冷藏24小时。不要冻结。
Ø 从冰箱中取出后,在9小时内完全注入稀释的溶液。
Ø 如果稀释后的溶液从冰箱中取出,则不得放回冰箱中。
Ø 如果冷藏时间超过24小时,或者从冰箱中取出后9小时内稀释溶液不能全部使用,则丢弃稀释溶液。
表1:根据患者体重得出的Nexviazyme给药的预计静脉输注量
|
患者体重范围(kg) |
20mg/kg时的总输注量(mL) |
40mg/kg时的总输注量(mL) |
|
5 to 9.9 |
N/A |
100 |
|
10 to 19.9 |
N/A |
200 |
|
20 to 29.9 |
N/A |
300 |
|
30 to 34.9 |
200 |
N/A |
|
35 to 49.9 |
250 |
N/A |
|
50 to 59.9 |
300 |
N/A |
|
60 to 99.9 |
500 |
N/A |
|
100 to 119.9 |
600 |
N/A |
|
120 to 140 |
700 |
N/A |
Ø 使用说明
当推荐剂量为20 mg/kg时
当推荐剂量为40mg/千克时
1. 建议使用在线、低蛋白结合、0.2微米过滤器使用Nexviazyme。
2. 根据患者的反应和感受,逐步输注。
Ø 初始和后续输注:建议的起始输注速率为1mg/kg/小时。如果没有输注相关反应(IAR)体征,则每隔30分钟按以下3个步骤逐渐增加输注速率:3mg/kg/小时、5mg/kg/小时,然后7mg/kg/小时;然后,将输注速率保持在7mg/kg/小时,直至输注完成。总输注时间约为4小时至5小时。
Ø 初始输注:建议的起始输注速率为1mg/kg/小时。如果没有IAR体征,则按以下三个步骤每隔30分钟逐渐增加输注速率:3mg/kg/小时、5mg/kg/小时,然后7mg/kg/小时;然后,将输注速率保持在7mg/kg/小时,直至输注完成(4步过程)。总输注时间约为7小时。
Ø 后续输注:建议的起始输注速率为1mg/kg/小时,如果没有IAR体征,则每30分钟输注速率逐渐增加一次。该工艺可采用上述4步工艺或以下5步工艺:3mg/kg/小时、6mg/kg/小时、8mg/kg/小时,然后是10mg/kg/小时;然后,将输注速率保持在10mg/kg/小时,直至输注完成。5步输液的大致总时长为5小时。
3. 输注完成后,用5%葡萄糖注射液冲洗静脉管路。
4. 9小时后,丢弃任何未使用的稀释产品。
5. 请勿将Nexviazyme与其他产品在同一静脉管线中输注。
【Nexviazyme的警告和注意事项】
1.超敏反应,包括过敏反应
在使用Nexviazyme之前,考虑使用抗组胺药、解热镇痛药和/或皮质类固醇进行预处理。在Nexviazyme给药期间,应随时提供适当的医疗支持措施,包括心肺复苏设备。
Ø 如果发生严重的超敏反应(如过敏反应),应立即停用Nexviazyme,并开始适当的药物治疗。应考虑严重超敏反应(包括过敏反应)后重新给予Nexviazyme的风险和益处。一些患者接受了以低于推荐剂量的较慢输注速率进行的再激发试验。在有严重超敏反应的患者中,可考虑对Nexviazyme进行脱敏治疗。如果决定重新使用Nexviazyme,确保患者耐受输注。如果患者耐受输注,则可增加剂量和/或速率,以达到批准的推荐剂量。
Ø 如果出现轻度或中度超敏反应,可减慢或暂时停止输注速率
2.输液相关反应
抗组胺药、解热药和/或皮质类固醇可在Nexviazyme给药前给药,以降低输注相关反应(IAR)的风险。然而,接受预处理后的患者仍可能发生IAR。
如果发生严重IAR,考虑立即停用Nexviazyme,开始适当的药物治疗,以及严重IAR后重新使用Nexviazyme的益处和风险。一些患者接受了以低于推荐剂量的较慢输注速率进行的再激发。一旦患者耐受输注,可增加剂量以达到推荐的批准剂量。
如果无论是否接受预处理均出现轻度或中度IAR,则降低输注速率或暂时停止输注可改善症状。
在输注Nexviazyme时患有急性基础疾病的患者发生IAR的风险似乎更大。晚期庞培病患者的心脏和呼吸功能可能受损,这可能使他们更容易发生IAR严重并发症
3.易感患者发生急性心肺衰竭的风险
易受液体容量超负荷影响的患者,或有急性潜在呼吸系统疾病或心脏或呼吸功能受损且需要限制液体的患者,在输注Nexviazyme期间可能有心脏或呼吸状态严重恶化的风险。在这些患者输注Nexviazyme期间,应更频繁地监测生命体征。有些患者可能需要延长观察时间。
4.致癌、致突变、生育力损害
尚未对avalglucosidase alfa-ngpt进行评估致癌可能性的长期动物研究或评估致突变可能性的研究。
每隔一天静脉注射avalglucosidase alfa-ngpt,剂量高达50 mg/kg(未评估暴露量),对雄性或雌性小鼠的生育力没有不良影响
【Nexviazyme注射剂禁忌症】
无
【药物相互作用】
暂无相关信息
【Nexviazyme不良反应】
Nexviazyme的不良反应包括:
1.头痛,
2.疲劳,
3.腹泻,
4.恶心,
5.关节疼痛,
6.头晕、
7.肌肉疼痛,
8.痒,
9.呕吐,
10.呼吸急促,
11.皮肤发红、
12. 麻木和刺痛
13.荨麻疹
免疫原性
ADA交叉反应性研究显示,avalglucosidase alfa-ngpt抗体与alglucosidase alfa具有交叉反应性。
【Nexviazyme在特殊人群中使用】
1.妊娠
来自孕妇使用Nexviazyme病例报告的可用数据不足以评估重大出生缺陷、流产或不良母体或胎儿结局的药物相关风险。然而,上市后报告和已发表的病例报告中有关孕妇使用alglucosidase(另一种水解溶酶体糖原特异性酶替代疗法)的可用数据未发现药物相关的不良妊娠结局风险。妊娠期庞贝病的继续治疗应针对孕妇个体化。未经治疗的庞贝病可能会导致孕妇的疾病症状恶化。
2哺乳期
没有关于人或动物乳中存在avalglucosidase alfa-ngpt、对母乳喂养婴儿的影响或对产奶量的影响的数据。可用的已发表文献表明人乳中存在alglucosidase(另一种水解溶酶体糖原特异性酶替代疗法)。在考虑母乳喂养对发育和健康的益处的同时,还应考虑母亲对Nexviazyme的临床需求以及Nexviazyme或潜在母体疾病对母乳喂养儿童的任何潜在不良影响。
3.儿科使用
已确定Nexviazyme治疗1岁及以上儿童迟发性庞贝病的安全性和有效性。两项临床研究(包括成人LOPD病患者和1名儿童LOPD病患者(16岁))的证据以及19名使用Nexviazyme治疗的婴儿型Pompe病(IOPD) (1至12岁)儿童患者的安全性经验均支持将Nexviazyme用于此适应症。Nexviazyme未被批准用于IOPD治疗。
Nexviazyme在1至12岁庞贝病儿童患者中的安全性概况与Nexviazyme在老年LOPD病儿童和成人患者中的安全性概况相似。尚未确定Nexviazyme在1岁以下儿童患者中的安全性和有效性。。
4.老年使用
Nexviazyme的临床研究包括14名65至74岁的患者和3名75岁及以上的患者。老年患者的推荐剂量与年轻成人患者的推荐剂量相同。
【Nexviazyme一般描述】
Avalglucosidase alfa-ngpt是一种水解溶酶体糖原特异性重组人α-葡糖苷酶,与多种合成的双甘露糖-6-磷酸(双-M6P)-四甘露糖聚糖缀合,每摩尔酶产生约15mol M6P(15 M6P),产于中国仓鼠卵巢细胞(CHO)。Avalglucosidase alfa-ngpt的分子量约为124 kDa。
注射用Nexviazyme (avalglucosidase alfa-ngpt)是一种无菌的白色至淡黄色冻干粉,经重新配制和稀释后可用于静脉注射。每个单剂量药瓶中含有100 mg的avalglucosidase alfa-ngpt、甘氨酸(200 mg)、L-组氨酸(10.7 mg)、L-组氨酸盐酸盐(6.5 mg)、甘露醇(200 mg)和聚山梨酯80 (1 mg)。用10 mL无菌注射用水重新配制后,所得浓度为100 mg/10 mL (10 mg/mL),pH值约为6.2。
【Nexviazyme作用机制】
庞贝病(也称为糖原累积病II型、酸性麦芽糖酶缺乏症和糖原累积病II型)是一种由溶酶体酶酸性α-葡萄糖苷酶(GAA)缺乏引起的糖原代谢的遗传性疾病,可导致糖原在各种组织中的溶酶体内积累。
Avalglucosidase alfa-ngpt提供外源性的GAA来源。Avalglucosidase alfa-ngpt上的M6P介导与细胞表面M6P受体的高亲和力结合。结合后,其被内在化并转运到溶酶体中,在此经历溶蛋白性裂解,导致GAA酶活性增加。Avalglucosidase alfa-ngpt在裂解糖原方面发挥酶活性。
【患者资讯资料】
1.超敏反应(包括过敏反应)和输液相关反应(IAR)
告知患者和护理人员,在Nexviazyme治疗期间和之后可能发生与输注相关的反应,包括过敏反应、其他严重或重度超敏反应和IAR。将超敏反应和IAR的体征和症状告知患者,并在出现体征和症状时让他们就医。
2.急性心肺衰竭的风险
告知患者和护理人员,有潜在呼吸系统疾病或心脏或呼吸功能受损的患者在输注Nexviazyme期间可能因容量超负荷而面临急性心肺衰竭的风险。
3.妊娠或哺乳期间的Nexviazyme暴露量
接触Nexviazyme的孕妇或哺乳期妇女或其医疗服务提供者应通过拨打1-800-745-4447(分机15500)报告Nexviazyme暴露量。
4.庞贝登记处
告知患者及其护理人员庞培登记处已经建立,以便更好地了解庞培病的可变性和进展,并继续监测和评估Nexviazyme的长期疗效。应鼓励患者及其护理人员参加庞培登记处,并告知他们的参与是自愿的,可能需要长期随访。如欲了解更多关于该注册计划的信息,请访问www.registrynxt.com或拨打1-800-745-4447,分机15500。
信息来源:
[1] https://www.drugs.com/newdrugs/fda-approves-nexviazyme-avalglucosidase-alfa-ngpt-late-onset-pompe-5624.html
[2] https://www.rxlist.com/nexviazyme-drug.htm
注:药品如有新包装,以新包装为准。以上资讯为高等医药院校的学生志愿者翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。



