美国食品和药物管理局(FDA)已批准Melinta公司旗下新药Baxdela用于治疗由易感细菌引起的急性细菌性皮肤和皮肤结构感染。而到目前为止,该药已研发17年,Baxdela的成功获批,为治疗急性细菌性皮肤和皮肤结构感染(ABSSSI)的成人患者提供了一个新的选择。
【德拉沙星(Baxdela,delafloxacin)适应证和用途】:
●适应症:德拉沙星(Baxdela,delafloxacin)是一种氟喹诺酮类抗菌药适用在成年为被指定的一种细菌所致的急性细菌性皮肤和皮肤结构感染(ABSSSI)的治疗。
●用途:减低耐药细菌的发展和维持BAXDELA和其他抗菌药的有效性,BAXDELA只应被使用治疗被证明或强烈地怀疑是细菌所致的感染。
【德拉沙星(Baxdela,delafloxacin)剂量和给药方法】:
●通过每12小时历时60分钟静脉输注给予注射用BAXDELA 300 mg,或每12小时口服一片450-mg BAXDELA片总时间共5至14天。
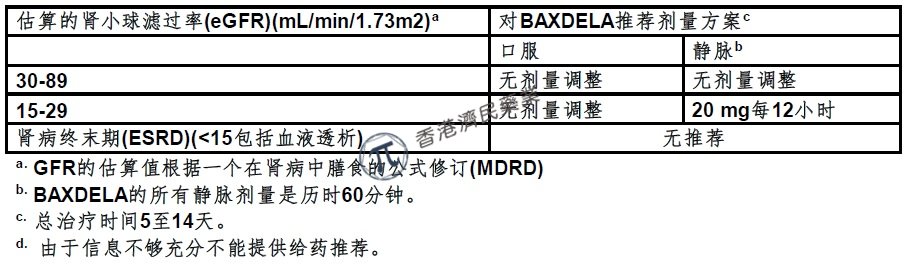
●对有肾受损患者剂量是根据估算的肾小球滤过率(eGFR)。
【德拉沙星(Baxdela,delafloxacin)剂型和规格】:
●注射用:300 mg的delafloxacin(等同于433 mg delafloxacin甲基葡胺[meglumine])作为一个冻干粉在一个单次剂量小瓶为静脉输注前重建和进一步稀释。
●口服片:450 mg delafloxacin(等同于649 mg delafloxacin甲基葡胺)。
【德拉沙星(Baxdela,delafloxacin)禁忌证】:
已知对Baxdela或其他氟喹诺酮类[fluoroquinolones]超敏性。
【德拉沙星(Baxdela,delafloxacin)警告和注意事项】:
1.失能和潜在地不可逆的严重不良反应包括肌腱炎和肌腱破裂,周围神经病变和中枢神经系统效应
氟喹诺酮类曽被伴随来自不同机体系统的失能和潜在地不可逆的严重不良反应在相同患者中可能仪器发生。常见不良反应包括肌腱炎,肌腱破裂,关节痛,肌痛,周围神经病变,和中枢神经系统效应(幻觉,焦虑,抑郁,失眠,严重头痛,和混乱)。这些反应可能一种氟喹诺酮类开始后小时至周内发生。任何年龄的患者或无预先存在风险因子曽经受这些不良反应。在任何严重的不良反应的首次体征或症状。此外,避免氟喹诺酮类的使用,包括BAXDELA,在经受这些严重的不良反应伴随氟喹诺酮类任何的患者立即地终止BAXDELA。
2 肌腱炎和肌腱破裂
01.在所有年龄氟喹诺酮类曽被伴随肌腱炎和肌腱破裂的增加风险。不良反应最频地涉及脚跟腱[Achilles tendon],和还曽被报道与旋转肌群[rotator cuff](肩膀,手,二头肌,拇指肌,和其他肌腱,开始一种喹诺酮类小时或天内可能发生肌腱炎或肌腱破裂,或喹诺酮类治疗后长达几个月。肌腱炎和肌腱破裂可能双侧地发生。
02.在患者在年龄超过60岁,在服药患者,和,在有肾,心,和肺移植患者喹诺酮类-伴随肌腱炎和肌腱破裂的发展的风险增加。其他因子可能独立地增加肌腱破裂的风险包括剧烈的身体活动,肾衰,和以前肌腱疾病例如类风湿性关节炎。肌腱炎和肌腱破裂也曽发生在服用氟喹诺酮类没有上述风险因子的患者。
03.如患者经受疼痛,肿胀,炎症或肌腱破裂立即地终止BAXDELA。建议患者,肌腱疼痛,肿胀,或炎症,的首次体征时停止服用BAXDELA,避免运动和受影响区域的使用,和及时联系他们的卫生保健提供者关于改变至一个非-喹诺酮类抗微生物药物。在有肌腱疾病或曽经受肌腱炎或肌腱破裂病史患者避免BAXDELA。
3.周围神经病变
01.氟喹诺酮类曽被伴随一个周围神经病变增加风险。感觉器官或感觉运动性轴索多发性神经病变影响小和/或大轴索导致皮肤感觉异常,感觉减退, 感觉迟钝,和软弱曽被报道在患者接受氟喹诺酮类,包括BAXDELA的病例。症状可能在氟喹诺酮类开始后马上发生和在有些患者中可能是可逆的。
02.终止BAXDELA立即地如患者经受周围神经病变的症状包括疼痛,烧灼,刺痛,麻木,和/或软弱或感觉的其他改变包括轻触,疼痛,温度,位置感觉,和振动感觉和/或运动强度为了to 缩小一种不可逆的条件的发展。在有以前经受周围神经病变患者中避免氟喹诺酮类,包括BAXDELA [见不良反应(6.1)]。
4.中枢神经系统效应
01.氟喹诺酮类曽被伴随一种中枢神经系统(CNS)反应的风险增加,包括:惊厥和颅内压增加(包括假脑瘤)和中毒性精神病。氟喹诺酮类,包括BAXDELA,还可能致神经质[nervousness],激动,失眠,焦虑,噩梦,妄想症,眩晕,混乱,震颤,幻觉,抑郁,和自杀想法或行动CNS反应。在首次剂量后可能发生这些不良反应。在接受BAXDELA患者中如发生这些反应,立即地终止BAXDELA和开始适当措施。因为用所有氟喹诺酮类,使用BAXDELA当治疗获益超过有有已知或怀疑CNS疾患风险患者(如,严重脑动脉脑动脉硬化,癫痫)或在存在其他风险因子使他们易于癫痫或癫痫阈值较低。
02.氟喹诺酮类有神经肌肉阻断活性和在有重症肌无力人们中可能加重肌肉软弱。上市后严重的不良反应,包括死亡和要求血管扩张剂支持,在有重症肌无力人们中曽被伴随喹诺酮类使用.在有已知重症肌无力病史患者避免BAXDELA。
5.超敏性反应
严重的和偶然地致命性超敏性(过敏性)反应,有些首次剂量后,在接受喹诺酮类治疗患者曽报道。有些反应伴随心血管虚脱,丧失意识,刺痛,咽喉或面水肿,呼吸困难,荨麻疹,和痒。 接受 BAXDELA患者曽报道超敏性反应。这些反应可能发生在BAXDELA的首次或随后剂量[见不良反应(6.1)]。在首次皮肤皮疹或其他超敏性任何征象出现终止BAXDELA。
6.艰难梭菌伴随腹泻
01.在接近地所有全身性抗菌药的使用者,包括BAXDELA曽报道艰难梭菌伴随腹泻(CDAD),有严重程度范围从轻度腹泻至致命性结肠炎。用抗菌剂治疗可能改变结肠正常菌丛,和可能允许艰难梭菌[C. difficile]过度生长。
02.艰难梭菌产生毒素A和B,它对CDAD的发生发展有贡献。艰难梭菌的高毒素生产菌株的产生增加的患病率和死亡率,因为这些感染对抗细菌治疗可能是难治性和可能需要结肠切除术。在所有患者抗菌使用后存在有腹泻必须考虑CDAD。有需要仔细考虑药物病史因为在抗菌剂给药后曽报道CDAD发生长于2个月。
03.如果CDAD被怀疑或确证,如可能,不是直接针对艰难梭菌正在进行的抗菌使用应被终止。当临床上有适应证时应开始适当措施例如液体和电解质处理,蛋白质补充,艰难梭菌的抗菌治疗,和手术评价。
7.耐药细菌的发生
在缺乏证明或强烈地怀疑细菌感染处方BAXDELA很可能对患者不提供获益和增加耐药细菌发生发展的风险。
【德拉沙星(Baxdela,delafloxacin)不良反应】:
最常见不良反应(发生率 ≥ 2%)是恶心,腹泻,头痛,转氨酶升高和呕吐。
【德拉沙星(Baxdela,delafloxacin)特殊人群中使用】:
1.妊娠
风险总结
在妊娠妇女中用BAXDELA数据有限是不足以告知重大出生缺陷和流产的一个药物伴随风险。 当delafloxacin(作为N-甲基葡糖胺盐)在器官形成阶段期被口服给予大鼠,未观察到畸形或胎儿死亡直至根据AUC 7倍估算的临床暴露。当大鼠被静脉地给予在妊娠后期和至哺乳,对子代无不良效应在暴露接近临床静脉(IV)暴露根据AUC[见数据]。
不知道对适应证人群重大出生缺陷和流产的背景风险。在美国一般人群,重大出生缺陷和在临床上认可临床流产的估算背景风险分别为2–4%和15–20%。
动物数据
在胚胎-胎儿研究中,在重大器官形成阶段期间口服给予delafloxacin至妊娠大鼠导致在母体毒性和减低的胎儿体重在最高剂量(1600 mg/kg/day)和胎儿骨化后延在所有剂量。无畸形被报道直至最高测试的剂量(根据AUC约7倍估算的人血浆暴露)。最低剂量,200 mg/kg/day(根据AUC约2.5倍估算的人血浆暴露),根据骨化后延,对胎儿仍是毒性。在兔中,一种种属已知对抗菌药的母体毒性极其敏感,未观察到胚胎-胎儿发育毒性直至最高剂量它诱导母体毒性(1.6 mg/kg/day,或根据 AUC约0.01倍估算的人血浆暴露)。在一项围产期研究在IV给予delafloxacin的大鼠,母兽在最高被测试剂量(120 mg/kg/day)表现出比对照动物略微减低体重和略微较长妊娠长度。在该剂量时暴露被估算根据AUC将是约5倍人血浆暴露,如同在一项分开的在妊娠一个较早阶段的较短期研究测定。在该剂量对幼畜效应包括增加哺乳期间死亡率,身材矮小,和较低体重,但报道学习和记忆中,感觉器官功能,运动活性,发育地标[developmental landmarks],或生殖性能无变化。在该研究中对母体毒性幼畜发育的无不良效应水平(NOAEL)为60 mg/kg/day(约580 mg/day IV对一位60 kg患者,或正好低于临床IV剂量)。
2.哺乳
风险总结
Delafloxacin在人乳汁中的存在,对哺乳喂养婴儿的影响,或对乳汁产生的影响不能得到数据。 Delafloxacin被排泄在大鼠哺乳乳汁中[见数据]。哺乳喂养的发育和健康获益应与母亲对BAXDELA的临床需求和哺乳喂养儿童来自BAXDELA或来自潜在母体情况任何潜在不良效应一并考虑。
数据:
单次口服剂量20 mg/kg后(约194 mg对60 kg患者)14C标记delafloxacin在产后天11,放射性被转移至哺乳大鼠的乳汁。给药后4和8小时在母兽中均数乳汁/血浆放射性浓度比值分别为8.5和4.0,和至24小时基本上背景。在乳汁和血浆中放射性消除速率相似。观察哺乳后被幼兽放射性药物的吸收。
3.儿童使用
建议在18岁以下患者不使用。尚未确定在18岁以下儿童患者中安全性和有效性。未进行儿童研究因为风险-获益考虑不支持在这个人群中使用BAXDELA为ABSSSI。在幼年动物中氟喹诺酮类致关节病变。
4.老年人使用
TYMLOS的绝经骨质疏松症临床研究患者总数中, 82%是年龄65 years 岁和以上,和19% 为年龄75岁和以上。这些受试者和较年轻受试者间未观察到安全性或有效性总体差别,但不能除外有些老年人更大灵敏性。
5.肾受损
对有轻度,中度,或严重肾受损患者无需剂量调整。在有正常肾功能或轻度,中度,或严重肾受损受试者中进行一项单次剂量TYMLOS 80 µg皮下给予研究。在有严重肾受损受试者中,与有正常肾功能受试者比较,Abaloparatide的最高浓度(Cmax )和浓度-时间曲线下面积(AUC)分别增加1.4和2.1-倍。有严重肾受损患者可能有增加的abaloparatide暴露可能增加不良反应的风险增加。
【德拉沙星(Baxdela,delafloxacin)药物过量】:
用Baxdela药物过量的治疗应应由观察和一般支持措施组成。静脉给予Baxdela后血液透析去除约19%的delafloxacin和56%的SBECD(Sulfobutylether β cyclodextrin)。
【德拉沙星(Baxdela,delafloxacin)贮存和处置】:
1.Baxdela片和注射用Baxdela应被贮存在20°C至25°C(68°F至77°F);外出允许至15°C至30°C(59°F至86°F)[见USP控制室温度]。
2.重建的粉可被贮存共至24小时在冰箱或控制室温度和然后进一步稀释为静脉输注。在输注袋中重建的溶液可被贮存在冰箱或控制室温度条件共至24小时。不要冻结。
注:药品如有新包装,以新包装为准。以上资讯为高等医药院校的学生志愿者翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。