优时比(UCB)近日宣布,美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)已分别受理了新型抗炎药bimekizumab的生物制品许可申请(BLA)和营销授权申请(MAA),该药用于治疗中重度斑块型银屑病成人患者。
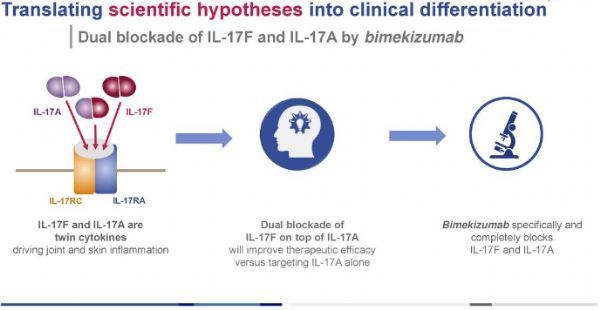
bimekizumab是一种具有双重作用机制的独特分子,这是一种新型人源化单克隆IgG1抗体,能强效、选择性地中和IL-17A和IL-17F,这是驱动炎症过程的2种关键细胞因子。IL-17A和IL-17F具有相似的促炎功能,并独立地与其他炎症介质合作,在多个组织中驱动慢性炎症和损害。
bimekizumab独特的IL-17A/IL-17F双重抑制可能为治疗免疫介导的炎症性疾病提供一种新的靶向疗法。在疾病相关细胞中的临床前研究显示,在抑制IL-17A的同时抑制IL-17F能够减少皮肤和关节炎症以及病理性骨形成,其程度大于单独抑制IL-17A的程度。目前,bimekizumab正处于III期临床开发,用于治疗多种炎症性疾病,包括斑块型银屑病、银屑病关节炎、中轴型脊柱关节炎、化脓性汗腺炎。
bimekizumab的监管申请文件,基于全球银屑病3期临床开发项目的数据。所有3期研究均达到了主要终点,结果显示:采用银屑病面积和严重程度指数(PASI 90)和调查员全球评估(IGA)皮损完全清除或几乎完全清除(IGA 0/1)评价,与接受安慰剂的患者和接受Humira(阿达木单抗)的患者相比,接受bimekizumab治疗的患者在第16周获得了更优的皮损清除。
所有3期研究均达到了次要终点。2项研究显示,在第16周时,通过PASI 100测量,bimekizumab优于现有的生物疗法Stelara(喜达诺®,通用名:ustekinumab,乌司奴单抗,强生IL-12/IL-23抑制剂)和Humira(阿达木单抗)。此外,bimekizumab在实现快速反应方面(采用第4周PASI 75定义)优于安慰剂、Stelara、Humira。在所有研究中,临床反应维持长达一年。bimekizumab的安全性与早期临床研究一致,未发现新的安全信号。
原文出处:UCB Achieves Important Regulatory Milestone for Bimekizumab
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。