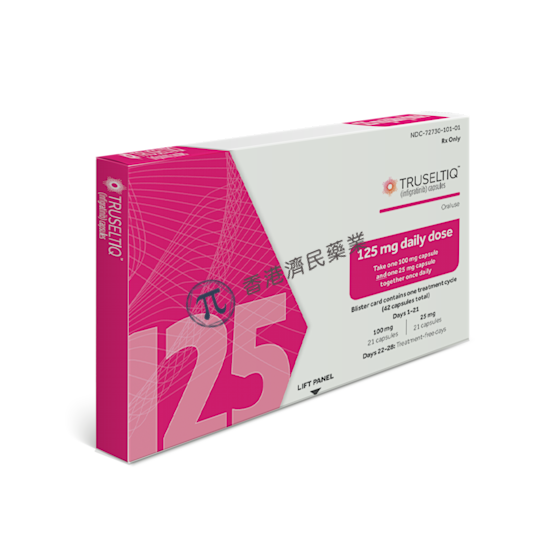
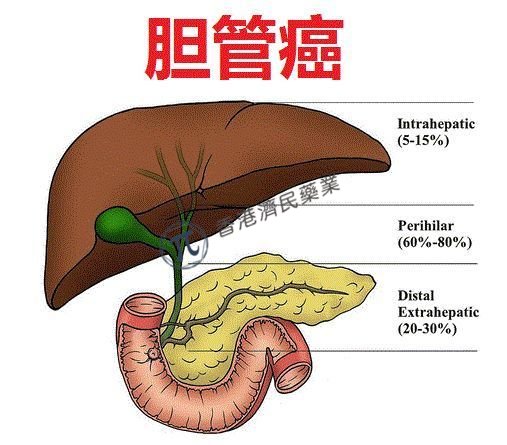
BridgeBio生物制药公司与Helsinn集团近日联合宣布,美国食品和药物管理局(FDA)已加速批准口服、ATP竞争性、选择性FGFR酪氨酸激酶抑制剂Truseltiq(infigratinib),用于治疗先前接受过治疗、携带FGFR2融合或重排的局部晚期或转移性胆管癌(CCA)患者。
此次批准,基于一项2期临床研究的数据。该研究中,108例先前接受过至少一种疗法的晚期CCA患者,接受了Truseltiq每日一次125mg治疗,28天一个疗程,每个疗程服药21天、停药7天。在这些患者中,107例(99%)为IV期CCA。所有患者至少接受过1次系统疗法。
结果显示,接受Truseltiq治疗的患者中,客观缓解率(ORR)为23%(95%CI:16-32%),中位缓解持续时间(DoR)5.0个月(95%CI:3.7-9.3个月)。该研究中,Truseltiq的安全性和耐受性良好。
Truseltiq的活性药物成分为infigratinib,这是一种创新型、口服、成纤维细胞生长因子受体(FGFR)1-3选择性强效抑制剂,具有明确的新型化学结构及药理作用。
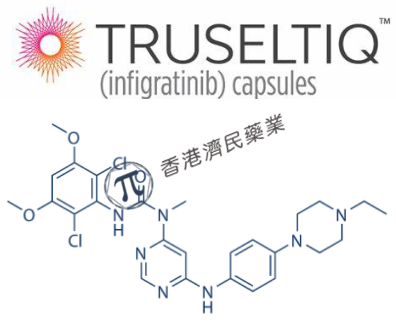 Truseltiq分子式
Truseltiq分子式
临床研究显示,infigratinib在治疗伴FGFR2基因融合的化疗难治型胆管癌患者和伴FGFR3基因组变异的晚期尿路上皮癌患者中疗效显著。
Truseltiq的获批,对于这些患者来说是一个重要的里程碑。Truseltiq将为FGFR2融合驱动型胆管癌患者带来一种新的靶向治疗选择。
原文出处:bridgebio pharma’s affiliate qed therapeutics and partner helsinn group announce FDA approval of truseltiq™ (infigratinib) for patients with cholangiocarcinoma
以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。