一、血液疾病
血友病A新型因子VIII疗法Altuviiio
赛诺菲(Sanofi)与Sobi共同开发Altuviiio(Efanesoctocog alfa)于2023年2月23日获美国食品药品监督管理局批准上市,治疗A型血友病成人和儿童的常规预防和按需治疗,以控制出血事件,以及围手术期管理(手术)。预计将于2023年下半年向欧盟提交监管文件。
Altuviiio(Efanesoctocog alfa)是一种一流的高持续因子VIII替代疗法,此次获批,Altuviiio成为首个也是唯一一个A型血友病治疗药物,每周一次给药,在一周的大部分时间内提供正常至接近正常的因子活性水平(超过40%),与之前的因子VIII预防相比,具有显著的出血保护作用。
批准Altuviiio是基于关键 XTEND-1 Ⅲ期研究的数据,试验结果显示,每周一次Altuviiio预防性治疗,显著降低严重血友病A患者中的年出血率。与此前接受的凝血因子VIII预防性治疗相比,Altuviiio在预防出血方面亦表现出优效性。
至于安全性,此药物也展现良好的耐受性,没有在患者体内观察到凝血因子VIII抑制剂的产生。最常见的治疗伴发不良反应(出现在>5%总病患中)包含头痛、关节疼痛(arthralgia)、跌倒与背痛。
二、肾脏疾病
Travere Therapeutics制药公司于2023年2月17日宣布美国食品药品监督管理局(FDA)已批准加速批准filspari(sparsentan)降低有快速疾病进展风险的原发性IgAN成人的蛋白尿,通常尿蛋白/肌酐比(UPCR) ≥1.5 g/g。这一适应症是根据蛋白尿的减少而加速批准的。尚未确定Filspari是否能减缓IgAN患者的肾功能衰退。该适应症的继续批准可能取决于在确认性临床试验中对临床益处的验证和描述。
Filspari是一种每日一次的口服药物,是一种内皮素和血管紧张素II受体拮抗剂。旨在选择性靶向IgAN疾病进展中的两个关键途径(内皮素-1和血管紧张素II),是第一个也是唯一一个被批准用于治疗这种疾病的非免疫抑制疗法,用于减少有快速疾病进展风险(通常为尿蛋白与肌酐之比(UPCR) ≥1.5g/g)的原发性IgAN成人的蛋白尿。
批准是根据FDA的加速批准途径批准的,是基于在关键和正在进行的3期PROTECT研究(IgAN迄今为止最大的头对头干预研究)中,与活性对照相比,蛋白尿有临床意义和统计上的显著改善。
至于安全性,最常见的不良反应(≥ 5%)是外周水肿、低血压(包括直立性低血压)、头晕、高钾血症和贫血。由于肝损伤和出生缺陷的风险,Filspari只能通过FDA批准的风险评估和缓解策略(REMS)获得。
2.Jesduvroq被批准用于透析患者的慢性肾病贫血
美国食品药品管理局(FDA)于当地时间2023年2月1日宣布批准葛兰素史克(GSK)开发的Jesduvroq(daprodustat)上市,这是首款治疗慢性肾病(CDK)贫血成人患者的口服药物,具体用于作为已接受至少4个月透析的慢性肾性贫血成人患者。但需指出的是,Jesduvroq尚未被批准用于治疗未接受透析治疗的患者。针对这种情况的其他FDA批准的治疗方法是注射入血液或皮下。
值得一提的是,Jesduvroq(daprodustat)片剂的获批,为广大CKD贫血患者提供一种更为方便的口服治疗方案。
FDA的批准是基于ASCEND-D试验的结果,该试验评估了Jesduvroq治疗透析患者CKD贫血的有效性和安全性。结果发表在《新英格兰医学杂志》上,附加结果发表在《新英格兰医学杂志》附录中。
在这项研究中,成人接受口服Jesduvroq或注射重组人促红细胞生成素(慢性肾病贫血患者的标准护理治疗)。Jesduvroq将血红蛋白(红细胞中携带氧气的蛋白质,是贫血的常用指标)提高并维持在10-11克/分升的目标范围内,与重组人红细胞生成素相似。
至于安全性,Jesduvroq最常见的副作用包括高血压、血栓性血管事件、腹痛、头晕和过敏反应。Jesduvroq的安全性信息还包括死亡、心肌梗死、中风、静脉血栓栓塞和血管通路血栓形成风险增加的黑框警告。Jesduvroq增加了血栓性血管事件的风险,包括主要的心血管不良事件(MACE)。
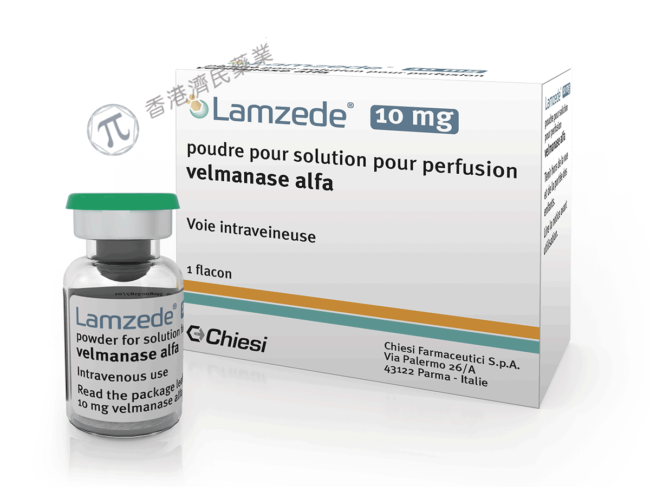
三、代谢紊乱
2023年2月16日,Chiesi集团宣布美国食品药品监督管理局(FDA)已批准Lamzede (velmanase alfa-tycv)用于治疗成人和儿童患者的α-甘露糖苷症(AM)的非中枢神经系统表现。
此次的获批,Lamzede成为首个也是唯一一个用于治疗成人和儿童患者α-甘露糖苷症非中枢神经系统表现的酶替代疗法。
四、肌肉骨骼疾病
1.Kevzara获准用于风湿性多肌痛
据Sanofi公司于2023年2月28日宣布,美国食品和药物管理局(FDA)已经批准了其药物Kevzara(sarilumab)额外适应症,用于治疗对皮质类固醇应答不充分或不能耐受皮质类固醇减量的成人患者的风湿性多肌痛(PMR)。
该药现在可被用于治疗两种慢性炎症性疾病,其此前已批准用于治疗对一种或多种改善疾病的抗风湿药物应答不充分或不耐受的中度至重度活动性类风湿性关节炎(RA)。
此次批准是基于3期数据,表明与安慰剂相比,使用Kevzara治疗的患者达到持续缓解的人数几乎增加了三倍。这是FDA批准的第一个也是唯一一个用于治疗风湿性多肌痛的生物制剂,可以帮助缓解该疾病的致残症状和对类固醇的长期依赖。
2.Skyclarys被批准用于弗里德里克共济失调
据Reata Pharmaceuticals, Inc.于2月28日宣布,美国食品药品监督管理局(FDA)已批准其药物SKYCLARYS(omaveloxolone),用于治疗成人和16岁及以上青少年弗里德里希共济失调(Friedreich共济失调)。该公司表示,Skyclarys是第一种也是唯一一种适用于弗里德里希共济失调患者的药物。
该药物已获得美国FDA的孤儿药、快速通道和罕见儿科疾病称号,以及欧洲委员会(EC)的孤儿药称号。此外,欧洲药品管理局(EMA)目前正在审查该药物的上市授权申请。
五、肿瘤疾病
trodelvy治疗HER2阴性、HR阳性转移性乳腺癌
吉利德科学公司于东部时间2023年2月3日宣布美国食品药品监督管理局(FDA)已经批准Trodelvy(sacituzumab govitecan-hziy,中文名:戈沙妥珠单抗)用于治疗患有不可切除的局部晚期或转移性激素受体(HR)阳性、人类表皮生长因子受体2 (HER2)阴性(IHC 0、IHC 1+或IHC 2+/ISH –)乳腺癌的成年患者,这些患者已经接受了基于内分泌的治疗和至少两种额外的系统性治疗。
该批准基于3期TROPiCS-02研究中具有统计学意义和临床意义的无进展生存期和总生存期数据。在TROPiCS-02研究中,与对照单药化疗(医生选择的治疗)相比,Trodelvy显示了具有统计学意义和临床意义的3.2个月总生存期(OS)益处;TPC)(中位OS: 14.4个月对11.2个月;危险比[HR]= 0.79;95% CI:0.65-0.96;p=0.02)。
六、眼科疾病
1.EYLEA(aflibercept)注射液治疗早产儿视网膜病变
Regeneron Pharmaceuticals(再生元)于2023年2月8日宣布美国食品药品监督管理局(FDA)已批准EYLEA(aflibercept)注射液治疗早产儿视网膜病变(ROP)。
EYLEA是由Regeneron和拜耳联合开发的一种VEGF抑制剂,被配制成用于眼部的注射剂。它旨在通过阻断VEGF-A和胎盘生长因子(PLGF),即参与眼部血管生成的两种生长因子,来阻止新血管的生长,并降低液体通过眼睛血管的能力(血管渗透性)。
EYLEA (aflibercept)在获得首个儿科适应症批准后,EYLEA已在全球100多个国家获准用于成人5个适应症,现在被用于治疗由眼部血管生成引起的五种视网膜疾病,即治疗患有新生血管性(湿性)年龄相关性黄斑变性、视网膜静脉阻塞后的黄斑水肿、糖尿病性黄斑水肿和糖尿病性视网膜病的成人。
2.Syfovre治疗继发于年龄相关性黄斑变性的地理萎缩
据Apellis制药2023年2月17日宣布,美国食品药品监督管理局(FDA)已批准Syfovre(pegcetacoplan)注射剂用于治疗继发于年龄相关性黄斑变性(AMD)的地理萎缩(GA)。该药目前也在欧洲药品管理局接受监管审查,预计2024年初做出决定,此外在加拿大也已提交了新药申请。
Syfovre是首个FDA批准用于治疗地理萎缩的方法。不过需要注意的是,在临床试验中,Syfovre虽然减缓了疾病进展标志物的生长,但未减缓患者视力的退化。
FDA对Syfovre的批准是基于两项假对照3期研究的结果,每项研究都有每月一次给药和每隔一个月一次给药的队列。使用pegcetacoplan治疗实现在24个月时测量的病变生长速度降低,这在两项关键研究中具有可比性。
这两项研究的患者还参与了一项扩展研究,该研究将对他们进行为期3年的跟踪观察,以观察在24个月时观察到的效果是否会持续。在接受每月一次pegcetacoplan给药的队列中,在第18至24个月测量的病变生长最大减少量为36%。
在这两项关键研究中,报告的最常见不良反应是眼部不适、新生血管性年龄相关性黄斑变性(AMD的“湿性”形式)、玻璃体飞蚊症和结膜出血。药物标签警告中称,眼部注射可能导致一种称为眼内炎和视网膜脱离的炎症,不过在临床试验中,不到1%的患者报告了这些问题。
以上这些就是2023年2月美国食品药品监督管理局(FDA)获批准的新药。
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。