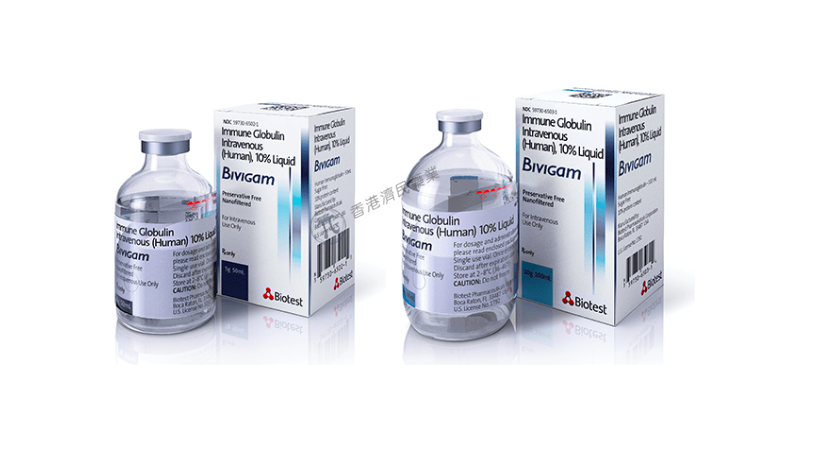
ADMA Biologics, Inc.于12月12日宣布,美国食品药品监督管理局(FDA)已将Bivigam(静脉注射人免疫球蛋白,10%液体)的批准范围扩大至2岁及以上患有原发性体液免疫缺陷(如常见变异免疫缺陷、X连锁无丙种球蛋白血症、先天性无丙种球蛋白血症、Wiskott-Aldrich综合征、严重联合免疫缺陷)的儿科患者。此前,Bivigam的适应症仅限于12岁及以上的原发性体液免疫缺陷患者。
Bivigam于2019年5月获得FDA批准,适用于治疗原发性体液免疫缺陷,包括一组遗传性疾病:X-连锁和先天性无丙种球蛋白血症、常见变异型免疫缺陷、Wiskott-Aldrich综合征和严重联合免疫缺陷。
此次批准得到了一项前瞻性、开放标签、单组研究(ClinicalTrials.gov标识符:NCT03164967)数据的支持,该研究在16名2至16岁患有与体液免疫缺陷相关的原发性免疫缺陷疾病的儿科参与者中进行。研究参与者每3或4周接受一次Bivigam输注,持续约5个月。
疗效基于急性严重细菌感染(SBIs)的发生率。结果显示,在平均152天的观察期内,没有急性SBIs发生。在此期间没有因感染住院的报告,也没有患者需要静脉注射抗生素 。在整个研究过程中,所有患者的谷总IgG水平都保持在500mg/dL以上。
此外,Bivigam也在第二个开放标签的单组试验中进行了评估,该试验纳入了63名参与者,其中9名是儿童。发现Bivigam在儿童和成人患者中的药代动力学、安全性和疗效相似。在12个月的研究期间,有2名参与者报告了2次SBI(均为细菌性肺炎);SBIs的年平均发生率为0.037。
观察到Bivigam最常见的不良反应(在≥5%的临床研究受试者中报告)为头痛、疲劳、输注部位反应、恶心、鼻窦炎、血压升高、腹泻、头晕和嗜睡。
Bivigam以含有10% IgG(100毫克/毫升)的液体溶液形式提供,装在50毫升和100毫升的一次性小瓶中。它以静脉输注的方式给药。
参考来源:
ADMA Biologics announces FDA approval for Bivigam® in the pediatric patient setting for those 2 years of age and older. News release. ADMA. December 12, 2023.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。