根据FDA官网显示,2023年12月已对多款“first-in-class”新药、新适应症的批准做出监管决定,其中包括治疗脂溢性皮炎、镰状细胞病、神经母细胞瘤、阵发性夜间血红蛋白尿症等。
一、皮肤病
商品名:Filsuvez
适应症:交界性和营养不良性大疱性表皮松解症
研发公司:Chiesi
据Chiesi全球罕见病公司12月19日宣布,美国食品药品监督管理局(FDA)批准Filsuvez(Birch triterpenes,桦木三萜,前称:Oleogel-S10)外用凝胶,用于治疗6个月及以上交界性大疱性表皮松解症(JEB)和营养不良性大疱性表皮松解症(DEB)患者的部分厚度伤口。
此前,该药物于去年6月获得欧盟委员会批准,用于治疗成人和6个月及以上儿童的JEB和DEB皮肤伤口。今年8月,英国国家卫生保健和卓越研究所(NICE)推荐Filsuvez用于上述适应症,现已被批准在英国使用。
Filsuvez是一种无菌植物药物,含有两种桦树皮的干燥提取物。由天然存在的三萜类物质组成,包括桦木醇、桦木酸、赤藓醇、羽扇豆醇和齐墩果酸。虽然Filsuvez在治疗与大疱性表皮松解症相关的伤口中的确切作用机制尚不清楚,但已证明桦树皮具有抗炎、抗微生物和伤口愈合的特性。
新闻稿称:Filsuvez外用凝胶是第一个获批治疗JEB相关伤口的治疗方法 。
适应症:脂溢性皮炎
研发公司:Arcutis Biotherapeutics, Inc.
Arcutis Biotherapeutics, Inc.于12月15日宣布,美国食品药品监督管理局(FDA)已批准ZORYVE(罗氟司特)0.3%外用泡沫剂的新药申请(NDA),用于治疗成人和9岁及以上儿童患者的脂溢性皮炎。
ZORYVE外用泡沫含有罗氟司特,罗氟司特是一种高效和选择性的磷酸二酯酶-4(PDE4)抑制剂。PDE4是一种细胞内酶,能增加促炎介质的产生,减少抗炎介质的产生。它是皮肤病学的一个既定靶点。
值得一提的是,ZORYVE (罗氟司特)0.3%是一种每日一次的不含类固醇的泡沫剂,也是二十多年来首个获准用于脂溢性皮炎的新作用机制药物。在STRATUM试验中,已被证明ZORYVE泡沫是一种高效、安全、耐受性好的脂溢性皮炎新药,可快速清除疾病并显著减轻瘙痒。
对于毛发生长区域的患者,像霜、凝胶和软膏这样的局部用品很难涂抹使用。ZORYVE泡沫制剂获准用于身体的任何部位,可以说是一种理想的配方,有可能成为脂溢性皮炎治疗的新标准。
二、血液疾病
商品名:Alvaiz
适应症:ITP、丙型肝炎血小板减少症和严重再生障碍性贫血
研发公司:Teva制药
12月1日,美国食品药品监督管理局(FDA)已批准Teva制药公司其血小板生成素(TPO)受体激动剂Alvaiz(eltrombopag片剂)用于治疗以下疾病:
• 患有持续性或慢性免疫性血小板减少症(ITP)的6岁及以上成人和儿童患者的血小板减少症,这些患者对皮质类固醇、免疫球蛋白或脾切除术反应不足。它仅应用于血小板减少程度和临床状况会增加出血风险的ITP患者。
• 慢性丙型肝炎成人患者的血小板减少,允许开始和维持干扰素治疗。它仅应用于慢性丙型肝炎患者,其血小板减少的程度阻止了基于干扰素的治疗的开始或限制了维持基于干扰素的治疗的能力。
• 对免疫抑制治疗反应不足的成人严重再生障碍性贫血(SAA)。
使用限制:Alvaiz不适用于骨髓增生异常综合征(MDS)患者的治疗。与不含干扰素的直接作用抗病毒药物联合使用治疗慢性丙型肝炎感染的安全性和有效性尚未确定。
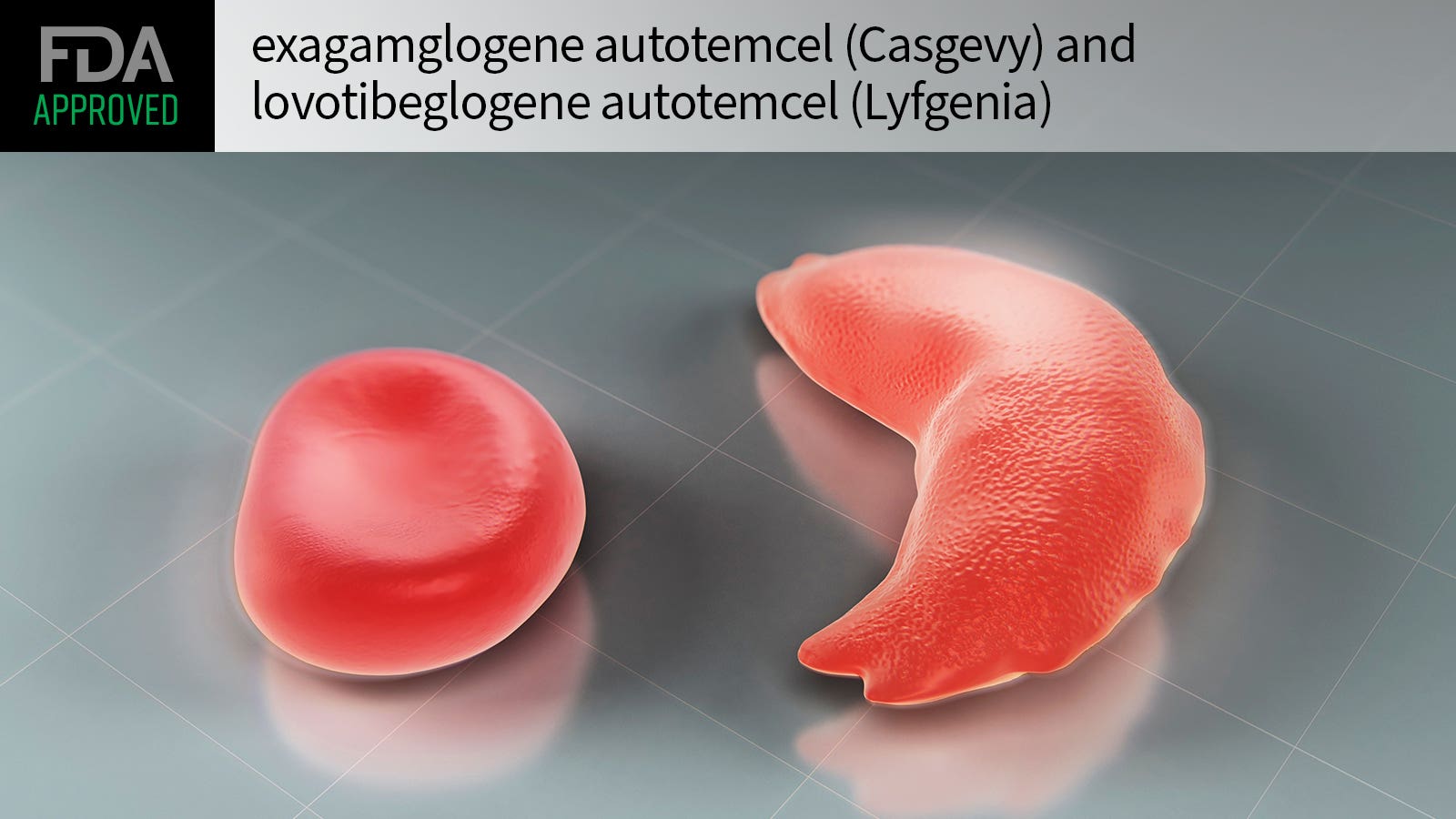
商品名:Casgevy
适应症:镰状细胞病
研发公司:Vertex制药/CRISPR治疗学公司
据Vertex制药和CRISPR治疗学公司12月8日联合宣布,美国食品药品监督管理局(FDA)已批准CRISPR/Cas9基因组编辑细胞疗法Casgevy(exagamglogene autotemcel,exa-cel)上市,用于治疗12岁及以上患有复发性血管闭塞性危象(VOCs)患者的镰状细胞病(SCD)。新闻稿指出:这是FDA批准的首款CRISPR基因编辑疗法。
Casgevy是一种基因组编辑细胞疗法,由自体CD34+造血干细胞 (HSC) 组成,通过CRISPR/Cas9技术在BCL11A基因的红细胞特异性增强子区域进行编辑。 Casgevy旨在通过造血干细胞移植程序进行一次性给药,其中患者自身的CD34+细胞被修饰以减少红系细胞中BCL11A的表达,从而导致胎儿血红蛋白 (HbF) 的产生增加。 HbF是胎儿发育过程中自然存在的携氧血红蛋白的形式,然后在出生后转变为成人形式的血红蛋白。 Casgevy已被证明可以减少或消除SCD患者的血管闭塞危象。
商品名:Fabhalta
适应症:阵发性夜间血红蛋白尿症
研发公司:诺华制药
诺华制药(Novartis)公司于12月6日宣布美国食品药品监督管理局(FDA)已批准其补体B因子抑制剂Fabhalta(iptacopan)作为首个口服单一疗法,用于治疗成人阵发性夜间血红蛋白尿症(PNH)。
Fabhalta是一款首创(first-in-class)、口服、强效、选择性、小分子、可逆性补体因子B(FB)抑制剂。作为一种口服补体B因子抑制剂,该药物在免疫系统的替代补体途径中起作用,全面控制血管内外的红细胞(RBC)破坏。
值得一提的是,Fabhalta是FDA批准的唯一一种免疫系统补体途径的B因子抑制剂,可用于既往治疗和未接受治疗的PNH患者,该途径可驱动PNH1中补体介导的溶血。
商品名:Lyfgenia
适应症:镰状细胞病
研发公司:蓝鸟生物(bluebird bio)
蓝鸟生物(bluebird bio)公司于12月8日宣布,美国食品药品监督管理局(FDA)已批准一次性基因疗法Lyfgenia(lovotibeglogene autotemcel,lovo-cel)用于治疗有血管闭塞事件(VOE)病史的12岁及以上患者的镰状细胞病(SCD)。
Lyfgenia是一种在研、用于治疗SCD的一次性基因疗法,其设计目的是将改良形式的β-珠蛋白基因(βA-T87Q珠蛋白基因)的功能拷贝添加到患者自身的造血干细胞(HSCs)中。一旦患者具有βA-T87Q珠蛋白的基因,他们的红细胞可以产生能够抵抗血红细胞镰刀化的血红蛋白(HbAT87Q),从而降低镰状血红蛋白(HbS)的比例,目标是减少镰状红细胞、溶血和其他并发症。
商品名:Wilate
适应症:血管性血友病
研发公司:Octapharma USA
Octapharma USA在当地时间12月5日宣布,美国食品和药物管理局(FDA)扩大了Wilate(血管性血友病因子/凝血因子VIII复合物[人])的批准范围,将其纳入常规预防措施,以降低患有血管性血友病(VWD)的成人和6岁及以上儿童的出血频率。
Wilate是第一个适用于所有形式的血管性血友病预防性治疗的血管性血友病因子(VWF)浓缩物。针对血管性血友病患者,Wilate还被批准用于按需治疗和控制出血事件以及围手术期出血管理。该药物还适用于患有A型血友病的成人和青少年:常规预防以减少出血事件的频率,以及按需治疗和控制出血事件。
三、免疫疾病
商品名:Alyglo
适应症:原发性体液免疫缺陷(PI)
研发公司:GC Biopharma
美国食品药品监督管理局(FDA)于12月17日批准了GC Biopharma的Alyglo(静脉注射免疫球蛋白,人-stwk,前称:GC5107) 10%液体,用于治疗17岁及以上成年患者的原发性体液免疫缺陷(PI)。
Alyglo是一种含有10%免疫球蛋白G (100mg/mL) 的静脉输注液体溶液,由美国捐赠者的混合血浆制成,可提供针对细菌和病毒病原体及其毒素的广谱中和IgG抗体。 该产品采用阳离子交换色谱法制造,可去除凝血因子XIa并降低促凝血活性。
四、肾脏疾病
商品名:Tarpeyo
适应症:IgA肾病
研发公司:Calliditas Therapeutics
Calliditas Therapeutics于12月20日宣布,美国食品药品监督管理局(FDA)已完全批准其缓释胶囊Tarpeyo(budesonide,布地奈德)用于治疗有疾病进展风险的原发性免疫球蛋白A肾病(IgAN)成人患者,以减少其肾功能丧失。
此前,该药以项目名称Nefecon开发,是第一种也是唯一一种用于降低患有原发性IgA肾病 (IgAN) 的成人患者的蛋白尿的治疗方法,该肾病有疾病快速进展的风险,通常尿蛋白与肌酐比 (UPCR) ≥1.5g/g。
TARPEYO是budesonide的口服缓释制剂,这是一种皮质类固醇,具有强效糖皮质激素活性和弱盐皮质激素活性,可进行大量首过代谢。该药被设计为一种4mg缓释胶囊,具有肠溶衣,因此在到达回肠之前会保持完整。每粒胶囊均含有布地奈德包被珠,其靶向回肠中存在的粘膜B细胞,包括负责产生引起IgA肾病的半乳糖缺陷IgA抗体(Gd-Ag1)的Peyer斑(派尔集合淋巴结)。尚不清楚Tarpeyo的疗效在多大程度上是通过回肠局部效应而不是全身效应介导的。
根据研发公司的新闻稿,Tarpeyo是美国FDA批准的首个能够显著减缓肾功能丧失的IgAN药物。
五、代谢紊乱
商品名:Wainua
适应症:ATTRv-PN
研发公司:阿斯利康/Ionis Pharmaceuticals
美国食品药品监督管理局(FDA)于12月21日宣布,已批准阿斯利康与Ionis Pharmaceuticals联合开发的反义寡核苷酸(ASO)疗法Wainua(eplontersen),用于治疗成人遗传性甲状腺素运载蛋白(TTR)介导的淀粉样变性病的多发性神经病,通常称为hATTR-PN或ATTRv-PN。
遗传性转甲状腺素蛋白介导的淀粉样多发性神经病(ATTRv-PN)是由周围神经中错误折叠的突变TTR蛋白的积累引起的。根据研发公司阿斯利康的说法,这种疾病会对大脑和脊髓以外的神经造成损害,如果不治疗,十年内可能会致命。
Wainua是一种配体结合的反义寡核苷酸(LICA)药物,旨在减少TTR蛋白在其来源的产生,该药物每月在家通过皮下注射给药一次。Wainua是FDA批准的首个可通过自动注射器自行给药用于治疗ATTRv-PN的药物。
六、肿瘤疾病
商品名:IWILFI
适应症:神经母细胞瘤
研发公司:USWM, LLC
据USWM, LLC(美国 WorldMeds)12月14日宣布,美国食品药品监督管理局 (FDA)已批准IWILFIN(eflornithine,依氟鸟氨酸)片剂,这是一种针对高危神经母细胞瘤的突破性口服维持疗法,具体适用于降低患有高危神经母细胞瘤的成人和儿童患者复发的风险,这些患者对先前的多药物、多模式治疗(包括抗GD2免疫治疗)至少有部分反应。
新闻稿指出:IWILFIN是一种特异性、不可逆的鸟氨酸脱羧酶抑制剂,是第一个也是唯一一个FDA批准的高危神经母细胞瘤口服维持疗法,旨在降低高危神经母细胞瘤患儿复发风险。
适应症:慢性淋巴细胞白血病或小淋巴细胞淋巴瘤
研发公司:礼来
礼来(Eli Lilly and Company)于12月1日宣布,美国食品药品监督管理局(FDA)批准Jaypirca (pirtobrutinib,吡妥布替尼,前称:LOXO-305)用于治疗患有慢性淋巴细胞白血病或小淋巴细胞淋巴瘤(CLL/SLL)的成年患者,这些患者之前至少接受了两种治疗,包括一种Bruton酪氨酸激酶(BTK)抑制剂和一种BCL-2抑制剂。
Jaypirca在FDA的加速批准途径下获得批准,其依据是开放标签、单组、多组、国际、1/2期BRUIN试验的总体缓解率(ORR)和缓解持续时间(DOR)。对该适应症的继续批准可能取决于在确认性试验中对临床益处的验证和描述。
Jaypirca是一种高选择性激酶抑制剂,也是唯一一个获得FDA批准的非共价(可逆)BTK抑制剂,该药利用一种新的结合机制来靶向与耐药性相关的特定突变。
2023年1月,该公司宣布FDA加速批准其新一代BTK抑制剂Jaypirca(pirtobrutinib)上市,用于三线及以上系统治疗(包括接受其他BTK抑制剂的治疗)的成人复发难治性套细胞淋巴瘤(MCL),这是一种罕见的血液癌症和一种非霍奇金淋巴瘤(NHL)。
新闻稿指出,这是FDA在2023年对Jaypirca的第二次批准,突显了在BRUIN试验中看到的Jaypirca继续利用BTK途径治疗CLL或SLL患者的有效临床益处。
商品名:Keytruda
适应症:尿路上皮癌
研发公司:默克
默克公司于12月15日宣布,美国食品药品监督管理局已批准Padcev(enfortumab vedotin-ejfv,恩诺单抗)与抗PD-1疗法KEYTRUDA(K药,pembrolizumab)作为联合疗法,用于治疗患有局部晚期或转移性尿路上皮癌(la/mUC)的成年患者。FDA比PDUFA的目标日期2024年5月9日提前近5个月批准了这一申请。
此次获批,该组合成为了适合或不适合接受顺铂化疗的患者的首选治疗选择。
商品名:Welireg
适应症:晚期肾细胞癌
研发公司:默克
12月15日,美国食品药品监督管理局(FDA)已批准默克公司口服治疗药物Welireg(belzutifan,贝组替凡),用于治疗在接受程序性死亡受体1(PD-1)或程序性死亡配体1(PD-L1)抑制剂和血管内皮生长因子酪氨酸激酶抑制剂(VEGF-TKI)后的晚期肾细胞癌(RCC)成年患者。
Welireg是一种口服缺氧诱导因子-2α(HIF-2α)抑制剂,最初于2021年获得FDA批准,用于治疗希佩尔·林道综合征(VHL综合征)成人患者,这是一类罕见的遗传性疾病,会导致不同器官(尤其是肾脏)肿瘤生长。
默克公司表示,Welireg获批用于治疗晚期肾细胞癌使其成为同类药物中第一个获批用于该疾病的药物,也是自2015年以来第一个新型治疗类别中的药物。作为HIF-2α的抑制剂,Welireg可减少与细胞增殖、血管生成和肿瘤生长相关的HIF-2α靶基因的转录和表达。HIF-2α是肾细胞肿瘤发展的关键调节因子。
七、眼科疾病
商品名:iDose TR
适应症:青光眼和高眼压
研发公司:Glaukos Corporation
眼科医疗技术和制药公司Glaukos Corporation于12月14日宣布,美国食品药品监督管理局(FDA)已批准其前列腺素类似物iDose TR(曲伏前列素前房内植入物)75mcg的新药申请(NDA),用于降低高眼压症(OHT)或开角型青光眼(OAG)患者的眼内压(IOP)。
iDose TR是一种含有75微克的新型曲伏前列素制剂的无菌前房植入物,经批准可单次给药。它通过微创外科手术植入眼内,植入后,75微克新型、不含防腐剂的曲伏前列素专有配方会通过膜控制扩散持续洗脱到前房中,从而实现24/7的药物释放;持续释放治疗水平的曲伏前列素至少一年。
曲伏前列素是一种用于降低眼内压(IOP)的前列腺素类似物。一旦所有的曲伏前列素被释放,iDose TR可以被移除并用新的替换。作为一种植入物,还为日常滴眼液治疗提供了一种有前途的替代方法,并可能缓解与日常滴眼液相关的粘附问题。
值得一提的是,iDose TR是一种首创、持续时间长的前房内程序药物疗法,旨在长时间持续在眼内提供24/7治疗水平的曲伏前列素专有配方。 该产品通过解决普遍存在的患者不依从问题和与局部青光眼药物相关的慢性副作用来提高护理标准。
以上就是对2023年12月FDA批准的所有新药作出简单汇总。
注:以上内容仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。