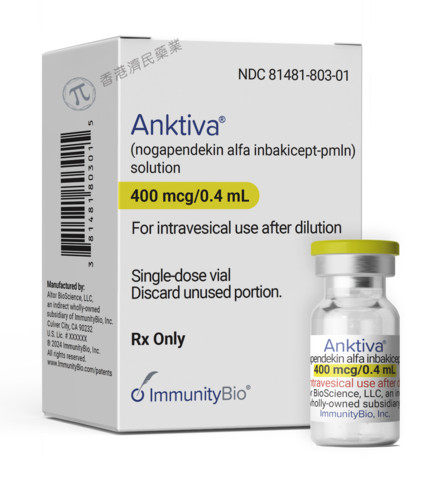
ImmunityBio制药公司于4月22日宣布,美国FDA批准Anktiva (nogapendekin alfa inbakicept-pmln,前称N-803) 联合卡介苗(BCG)用于治疗卡介苗无反应的非肌层浸润性膀胱癌(NMIBC)伴或不伴乳头状肿瘤的原位癌(CIS)成人患者。该公司表示,该产品预计将于今年5月中旬在美国上市。
膀胱癌是指发生在膀胱黏膜上的恶性肿瘤,是泌尿系统最常见的恶性肿瘤。膀胱尿路上皮癌约占所有膀胱恶性肿瘤的90%,根据其是否侵犯膀胱肌层可分为非肌层浸润性膀胱癌(NMIBC)和肌层浸润性膀胱癌(MIBC)。在诊断时,大约75-85%的膀胱癌存在局限于粘膜(Ta期,原位癌[CIS])或粘膜下层(T1期)疾病,这些类别被归类为非肌肉浸润性膀胱癌(NMIBC),其中约70%为Ta期,20%为T1期,10%为CIS。针对NMIBC的标准治疗是卡介苗(BCG)的膀胱内灌注(通过导管输送到膀胱)。卡介苗是一种良性细菌,可在癌细胞附近的膀胱中诱导免疫反应,从而清除许多患者的癌症。 然而,约30-40%的患者接种卡介苗失败,约50%的初始反应患者癌症会复发。
Anktiva是一种用于非肌层浸润性膀胱癌的一流细胞因子白细胞介素-15 (IL-15)激动剂免疫疗法,该药物与其受体的结合导致自然杀伤细胞、CD8+细胞和记忆T细胞的增殖和活化。 此前曾获得FDA用于治疗BCG无反应NMIBC CIS的突破性疗法和快速通道指定,以及用于BCG无反应NMIBC乳头状和BCG初治NMIBC CIS的快速通道指定。
ImmunityBio执行主席兼全球首席科学和医学官Patrick Soon-Shiong医学博士说:“这种模拟树突细胞生物学的新型作用机制开始了免疫疗法超越T细胞的发展。“关键的抗癌免疫细胞的增殖与具有记忆的T细胞的激活相结合,产生了持久的完整反应。”
美国FDA于2018年2月发布了针对BCG无应答非肌肉浸润性膀胱癌(NMIBC)的指南,指出BCG无应答NMIBC患者的治疗目标是避免膀胱切除术。目前该组合疗法在美FDA的获批,可以减少全球许多NMIBC患者对膀胱切除术的需求。
该监管决定得到了2/3期QUILT-3.032试验 (NCT03022825)数据的支持,在这项开放标签、多中心研究中,组织学证实的卡介苗无反应性原位癌伴或不伴Ta/T1乳头状疾病的患者被纳入队列A(n = 84)和队列C(n = 10),组织学证实的卡介苗无反应性高分级Ta/T1乳头状NMIBC患者被纳入队列B(n = 77)。A组和B组的患者被分配膀胱内注射400μg/滴注的nogapendekin,加上膀胱内注射50mg/滴注的BCG。 C队列中的患者被分配单独膀胱内注射nogapendekin,剂量为400μg/滴注。 所有队列中的患者每周接受一次导尿管治疗,持续6周,并在24个月内每3个月进行一次疗效评估,然后从24个月至60个月每6个月进行一次疗效评估。
队列A和C的主要终点是3个月和6个月的完全缓解率(CR),队列B的主要终点是12个月的无病生存率(DFS)。次要终点包括反应的持久性、膀胱切除术避免率、无进展生存期(PFS)、疾病特异性生存期(DSS)和总生存期(OS)。
在QUILT-3.032试验中,队列A的总体完全缓解率(CR)为71.0%(95% CI,59.6%-80.3%),其中包括接受膀胱内nogapendekin加卡介苗治疗的患者。在3个月时, 6个月和12个月的缓解评估中,CR率分别为55%(95% CI,43.5%-65.9%)、56%(95% CI,44.7%-67.0%)和45%(95% CI, 34.1%-56.5%)。
对治疗有反应的患者的CR中位持续时间为26.6个月(95% CI,9.9-未达到 [NR])。 截至数据截止时,28名患者仍处于CR状态。 值得注意的是,有2名患者在大约9个月时报告了初始CR,因为COVID-19或其他疾病延迟了6个月的就诊。
在B队列中,包括BCG无反应的高级别Ta/T1乳头状NMIBC患者,估计的12个月、18个月和24个月无病生存率(DFS)为55.4%(95% CI, 分别为42.0%-66.8%)、51.1% (95% CI, 37.6%-63.1%) 和48.3% (95% CI, 34.5%-60.7%)。 研究人员还强调该队列的中位DFS为19.3个月(95% CI,7.4-NR)。
此外,Anktiva-BCG组合对77名可评估患者的完全缓解率为62% (95% CI,51-73)。该公司表示,反应持续时间从0到47.0个月不等;58% (n=28)的完全缓解患者的缓解持续至少12个月,40% (n=19)的缓解持续至少24个月。
在队列C中,数据截止时间的中位时间为7.9个月。 3个月时,20%的患者达到CR,其中10人仅接受nogapendekin治疗。 此外,6名患者进行了再诱导,1名患者在6个月时保持CR。
Anktiva耐受性良好,不良事件与单独使用卡介苗一致。其中,A和B队列中最常见的治疗中出现的不良反应(TEAEs)是排尿困难、尿频和血尿。这些队列中共有86%的患者经历了至少一次1/2级TEAE,20%的患者经历了3级毒性,2%的患者发生了4级事件,1%的患者发生了5级TEAE。3级TEAEs包括血尿(2%)和尿路感染(2%)。1名心脏骤停患者出现5级TEAE,15%的患者出现TEAE并导致住院治疗。
此外,针对卡介苗无反应和卡介苗初治患者的Anktiva研究正在进行中。目前来说,关于正在进行的QUILT-3.032 (NCT03022825)分析的进一步更新将由Soon-Shiong博士在即将于2024年5月3日举行的美国泌尿协会年会上进行介绍。
ImmunityBio还指出,除了在NMIBC中进行的试验外,目前还在非小细胞肺癌、结直肠癌、非霍奇金淋巴瘤、胶质母细胞瘤、实体瘤和HIV的试验中对其进行研究。 未来的研究计划针对铂类耐药卵巢癌和急性髓性白血病。
参考来源:
FDA approves nogapendekin alfa inbakicept-pmln for BCG-unresponsive non-muscle invasive bladder cancer. News release. FDA. April 22, 2024. Accessed April 22, 2024.
ImmunityBio Announces FDA Approval of ANKTIVA®, First-in-Class IL-15 Receptor Agonist for BCG-Unresponsive Non-Muscle Invasive Bladder Cancer
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。