2022年10月25日,强生旗下杨森制药公司宣布,美国食品药品监督管理局(FDA)已加速批准Tecvayli(teclistamab-cqyv,特立妥单抗),用于治疗复发或难治性多发性骨髓瘤的成年患者,这些患者既往接受过4种或更多种既往治疗,包括蛋白酶体抑制剂、免疫调节药物和抗CD38单克隆抗体。
Tecvayli是全球首款靶向BCMA/CD3双抗,也是FDA批准的第五款单抗,此前已于2022年8月获欧盟批准,用于复发或难治性多发性骨髓瘤成人患者。
【生产企业】杨森制药公司
【规格】注射:30mg/3mL(10mg/mL)单剂量小瓶;153mg/1.7mL(90mg/mL)单剂量小瓶。
【商标】Tecvayli
【通用名】teclistamab-cqyv
【中文名】特立妥单抗
【贮藏】在2℃至8℃下冷藏储存在原纸箱中,以避免光照,不要冻结。
【Tecvayli适应症】
Tecvayli适用于患有复发性或难治性多发性骨髓瘤的成年患者的治疗,这些患者之前已经接受了至少四种疗法,包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体。该适应症根据缓解率获得加速批准,该适应症的继续批准可能取决于在确认性试验中对临床益处的验证和描述。
【Tecvayli推荐剂量和给药方法】
一、推荐剂量
仅用于皮下注射,Tecvayli的推荐给药方案见表1,Tecvayli的推荐剂量为0.06mg/kg和0.3mg/kg的递增剂量,随后为1.5mg/kg,每周一次,直至疾病进展或出现不可接受的毒性。在Tecvayli递增剂量方案的每次给药之前给予治疗前药物,该方案包括递增剂量1、递增剂量2和第一次治疗剂量,如表1所述。根据表1中的递增剂量方案皮下注射Tecvayli, 以降低细胞因子释放综合征(CRS)的发生率和严重程度。由于存在CRS和神经毒性(包括ICANS)的风险,在Tecvayli递增剂量方案中的所有剂量给药后,患者应住院48小时。
二、推荐的预处理药物
1、在Tecvayli递增剂量方案(包括递增剂量1、递增剂量2和第一次治疗剂量,见表1)的每次给药前1至3小时服用以下预处理药物,以降低CRS的风险:皮质类固醇(口服或静脉注射地塞米松16mg);组胺-1 (H1)受体拮抗剂(口服或静脉注射苯海拉明50mg或等效物);退烧药(口服或静脉注射对乙酰氨基酚650 mg至1000mg或等效物)。
2、以下患者在服用后续剂量的Tecvayli之前可能需要服用预处理药物:在延迟给药后重复Tecvayli递增给药方案中的剂量的患者;服用之前剂量的Tecvayli后出现CRS的患者。
3、带状疱疹复发的预防:在开始使用Tecvayli治疗之前,根据指南,考虑开始抗病毒预防以防止带状疱疹复发。
三、剂量延迟后重新使用Tecvayli
如果Tecvayli的剂量延迟,根据表2中的建议重新开始治疗,并相应地恢复治疗方案。按照表2所示服用治疗前药物。由于存在CRS和神经毒性(包括ICANS)的风险,患者应在Tecvayli递增剂量方案中的所有剂量给药后住院48小时。
四、不良反应的剂量调整
不建议减少Tecvayli的剂量,可能需要延迟给药以控制与Tecvayli相关的毒性。有关CRS、神经毒性和ICANS的不良反应的建议措施,请参见表3、4和5。有关Tecvayli给药后的其他不良反应的建议措施,请参见表6。
CRS、神经毒性和ICANS的管理:
①细胞因子释放综合征
表3总结了CRS的管理建议。根据临床表现识别CRS,评估和治疗发热、缺氧和低血压的其他原因。如果怀疑有CRS,暂停使用Tecvayli直到CRS解决。根据表3中的建议进行管理,并考虑根据当前实践指南进行进一步治疗。对CRS进行支持性治疗,这可能包括对严重或危及生命的CRS进行重症监护。考虑实验室检测,以监测弥散性血管内凝血(DIC)、血液学参数以及肺、心脏、肾和肝功能。
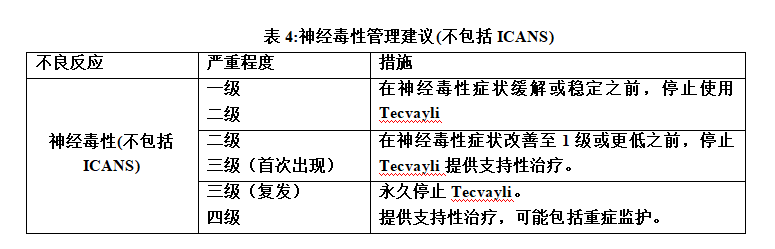
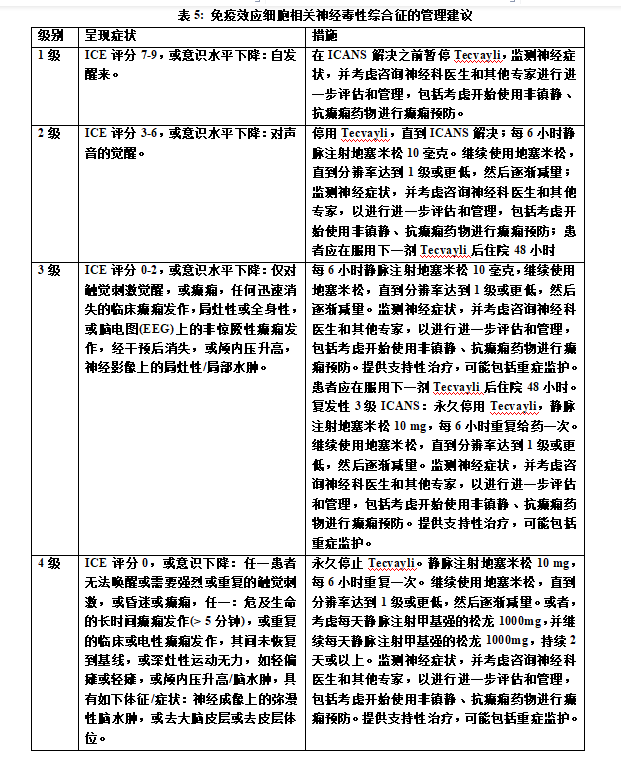
②神经毒性和ICANS
表4和表5总结了神经毒性和ICANS的管理建议。在出现神经毒性(包括ICANS)的第一个迹象时,停止Tecvayli并考虑神经病学评估。排除神经系统症状的其他原因。为严重或危及生命的神经毒性(包括ICANS)提供支持性治疗,可能包括重症监护。根据表5中的建议管理ICANS,并根据当前的实践指南考虑进一步的管理。
五、制备和给药
Tecvayli仅供医务人员皮下使用。Tecvayli应由拥有足够的医疗人员和适当的医疗设备来处理严重反应的医院给药,包括CRS和ICANS。Tecvayli是一种澄清至微乳白色、无色至淡黄色的溶液。只要溶液和容器允许,注射用药品在给药前应目视检查是否有颗粒物质和变色。如果溶液变色、浑浊或有异物,请勿使用。Tecvayli作为即用型溶液提供,在给药前不需要稀释。不要将不同浓度的Tecvayli小瓶混合在一起以达到治疗剂量。使用无菌技术制备和注射Tecvayli。
六、Tecvayli的制备
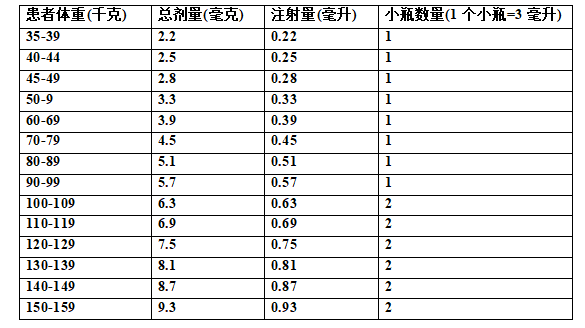
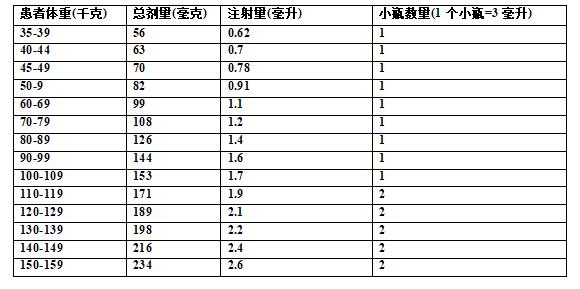
关于Tecvayli的制备,请参考以下参考表。使用Tecvayli 30mg/3mL (10mg/mL)小瓶,根据患者的实际体重,使用表7确定递增剂量1所需的总剂量、注射体积和小瓶数量。
使用Tecvayli 153mg/1.7mL (90mg/mL)药瓶,根据患者的实际体重,使用表9确定治疗剂量所需的总剂量、注射体积和药瓶数量。
从冷藏库中取出适当浓度的Tecvayli小瓶,将Tecvayli平衡至环境温度至少15分钟。不要以任何其他方式加热Tecvayli。达到平衡后,轻轻旋转小瓶约10秒钟,使其混合。不要摇晃。使用转移针将所需注射量的Tecvayli从小瓶中抽取到适当大小的注射器中。每次注射量不得超过2mL。将需要2毫升以上的剂量平均分配到多个注射器中。Tecvayli与不锈钢注射针和聚丙烯或聚碳酸酯注射器材料兼容。用合适尺寸的注射针头更换转移针头。
七、给药
将所需体积的Tecvayli注射到腹部的皮下组织中(优选的注射部位)。或者,Tecvayli可以注射到其他部位(例如大腿)的皮下组织中。如果需要多次注射,Tecvayli注射应至少相隔2cm。不要注射到纹身或疤痕或皮肤发红,擦伤,触痛,坚硬或不完整的区域。任何未使用的产品或废料都应按照当地要求进行处理。
八、监测
由于存在CRS和神经毒性(包括ICANS)的风险,在Tecvayli递增剂量方案中的所有剂量给药后,患者应住院48小时。
【Tecvayli的警告和注意事项】
一、细胞因子释放综合征
Tecvayli可导致细胞因子释放综合征(CRS),包括危及生命或致命的反应。在临床试验中,72%接受推荐剂量Tecvayli的患者出现CRS,其中50%的患者出现1级CRS,21%的患者出现2级CRS,0.6%的患者出现3级CRS。33%的患者出现复发性CRS。CRS发作的中位时间为最近一次给药后2天(范围:1至6天),中位持续时间为2天(范围:1至9天)。CRS的临床体征和症状包括但不限于发热、缺氧、寒战、低血压、窦性心动过速、头痛和肝酶升高(天冬氨酸转氨酶和丙氨酸转氨酶升高)。根据Tecvayli递增剂量方案开始治疗,以降低CRS风险。给予治疗前药物以降低CRS的风险,并在给予Tecvayli后对患者进行相应的监测。一旦出现CRS迹象,立即评估患者是否需要住院治疗。根据严重程度给予支持性治疗,并根据当前实践指南考虑进一步治疗。根据严重程度停用或永久停用Tecvayli。Tecvayli只能通过REMS下的受限程序获得。
二、神经毒性,包括ICANS
Tecvayli可导致严重或危及生命的神经毒性,包括免疫效应细胞相关神经毒性综合征(ICANS)。在临床试验中,接受推荐剂量Tecvayli的患者中有57%出现神经毒性,2.4%的患者出现3级或4级神经毒性。最常见的神经毒性是头痛(25%)、运动功能障碍(16%)、感觉神经病(15%)和脑病(13%)。ICANS的中位发病时间为最近一次给药后4天至8天,中位持续时间为3天。ICANS最常见的临床表现为意识模糊和书写困难。ICANS的出现可以与CRS同时发生,在CRS解决之后,或者在没有CRS的情况下。治疗期间,监测患者的神经毒性体征和症状。在出现神经毒性(包括ICANS)的第一个迹象时,立即评估患者,并根据严重程度提供支持性治疗。根据建议的严重程度暂停或永久停用Tecvayli,并根据当前实践指南考虑进一步治疗。由于潜在的神经毒性,接受Tecvayli的患者有意识水平下降的风险。建议患者在完成Tecvayli递增剂量方案期间和之后的48小时内,以及在出现任何新的神经毒性症状的情况下,避免驾驶或操作重型或有潜在危险的机器,直到神经毒性消失。
三、由于存在CRS和神经毒性(包括ICANS)的风险,Tecvayli只能通过REMS下称为Tecvayli REMS的受限计划获得。Tecvayli REMS的显著要求包括以下内容:处方医师必须通过注册和完成培训获得该计划的认证。处方医师必须告知接受Tecvayli的患者有关CRS和神经毒性(包括ICANS)的风险。配药Tecvayli的药房和医疗机构必须通过Tecvayli REMS计划的认证,并且必须确认处方医生通过了Tecvayli REMS计划的认证。批发商和分销商只能将Tecvayli分销给认证药店或医疗机构。
四、肝中毒
Tecvayli可导致肝毒性,包括死亡。在临床试验中接受推荐剂量Tecvayli的患者中,有一例致命的肝功能衰竭病例。34%的患者出现天冬氨酸转氨酶(AST)升高,1.2%的患者出现3级或4级升高。28%的患者出现丙氨酸氨基转移酶(ALT)升高,1.8%的患者出现3级或4级升高。6%的患者出现总胆红素升高,0.6%的患者出现3级或4级升高。肝酶升高可伴有或不伴有CRS。根据临床指征,在基线和治疗期间监测肝酶和胆红素。根据严重程度,停止使用Tecvayli或考虑永久停用Tecvayli。
五、感染
Tecvayli可导致严重的、危及生命的或致命的感染。在临床试验中以推荐剂量接受Tecvayli的患者中,包括机会性感染在内的严重感染发生率为30%,3级或4级感染发生率为35%,致死性感染发生率为4.2%。在Tecvayli治疗前和治疗期间,监测患者的感染体征和症状,并进行适当治疗。根据指南使用预防性抗菌药物。根据严重程度,停用Tecvayli或考虑永久停用Tecvayli。在Tecvayli治疗期间监测免疫球蛋白水平,并根据指南进行治疗,包括感染预防和抗生素或抗病毒预防。
六、嗜中性白血球减少症
Tecvayli可导致中性粒细胞减少和发热性中性粒细胞减少。在临床试验中接受推荐剂量Tecvayli的患者中,84%的患者出现中性粒细胞减少,56%的患者出现3级或4级中性粒细胞减少。3%的患者出现发热性中性粒细胞减少。在基线和治疗期间定期监测全血细胞计数,并根据当地机构指南提供支持性护理。监测中性粒细胞减少症患者的感染迹象。根据严重程度暂停Tecvayli。
七、过敏和其他给药反应
Tecvayli可引起全身给药相关反应和局部注射部位反应。全身反应:在接受临床试验中推荐剂量的Tecvayli的患者中,1.2%的患者出现全身给药反应,包括1级复发性发热和1级舌头肿胀。
局部反应:在临床试验中以推荐剂量接受Tecvayli的患者中,35%的患者发生注射部位反应,其中1级注射部位反应为30%,2级为4.8%。根据严重程度,停用Tecvayli或考虑永久停用Tecvayli。
八、胚胎-胎儿毒性
根据其作用机制,孕妇使用Tecvayli可能会对胎儿造成伤害。告知孕妇对胎儿的潜在风险。建议具有生殖潜力的女性在使用Tecvayli治疗期间以及在最后一次给药后的5个月内使用有效的避孕方法。
【Tecvayli禁忌症】
无。
【Tecvayli药物相互作用】
Tecvayli引起细胞因子的释放,可能抑制细胞色素P450 (CYP)酶的活性,导致CYP底物暴露增加。药物相互作用的最高风险预计发生在首次治疗剂量后7天内开始Tecvayli递增给药方案时以及CRS期间和之后。监测作为CYP底物的药物的毒性或浓度,其中最小的浓度变化可能导致严重的不良反应。根据需要调整伴随CYP底物药物的剂量。
【Tecvayli不良反应】
Tecvayli不良反应包括:细胞因子释放综合征;神经毒性,包括ICANS;肝毒性;感染;中性粒细胞减少症;过敏和其他给药反应。
【Tecvayli在特殊人群中使用】
1、妊娠
根据作用机制,孕妇使用Tecvayli可能会对胎儿造成伤害。尚无关于孕妇使用Tecvayli的可用数据。尚未对Tecvayli进行动物生殖或发育毒性研究。Teclistamab-cqyv引起T细胞活化和细胞因子释放;免疫激活可能会损害妊娠维持。已知人免疫球蛋白G (IgG)穿过胎盘;因此,teclistamab-cqyv有可能从母体传递给发育中的胎儿。告知妇女对胎儿的潜在风险。Tecvayli与低丙种球蛋白血症相关,因此,应考虑评估接受Tecvayli治疗的母亲的新生儿的免疫球蛋白水平。
2、哺乳期
没有关于母乳中存在teclistamab-cqyv、对母乳喂养儿童的影响或对泌乳量的影响的数据。已知母乳中存在母体IgG。尚不清楚母乳喂养儿童局部胃肠道暴露和有限全身暴露对Tecvayli的影响。由于母乳喂养的儿童可能出现严重的不良反应,建议患者在Tecvayli治疗期间以及最后一次给药后的5个月内不要进行母乳喂养。
3、具有生殖潜力的女性和男性
孕妇使用Tecvayli可能会对胎儿造成伤害。在开始Tecvayli之前,妊娠试验验证具有生殖潜力的女性的妊娠状态。建议有生育能力的女性在治疗期间和最后一剂Tecvayli后的5个月内使用有效的避孕方法。
4、儿科用药
Tecvayli在儿科患者中的安全性和有效性尚未确定。
5、老年用药
在MajesTEC-1中以推荐剂量使用Tecvayli治疗的165例复发或难治性多发性骨髓瘤患者中,48%为65岁或以上,15%为75岁或以上。与年轻患者相比,65-74岁患者在安全性或有效性方面没有观察到总体差异。75岁或以上的患者数量不足,无法评估其安全性或有效性是否存在差异。
【Tecvayli一般描述】
Teclistamab-cqyv是一种双特异性B细胞成熟抗原(BCMA)导向的CD3 T细胞接合物,是一种人源化免疫球蛋白G4-脯氨酸、丙氨酸、丙氨酸(IgG4-PAA)抗体。
使用重组DNA技术在中国仓鼠卵巢(CHO)细胞中产生Teclistamab-cqyv。Teclistamab-cqyv由抗BCMA重链和轻链以及抗D3重链和轻链组成,两条链间二硫键连接两条臂,teclistamab-cqyv的分子量约为146 kDa。
Tecvayli(teclistamab-cqyv)注射液是一种无菌、不含防腐剂、澄清至微乳白色、无色至浅黄色的溶液,采用单剂量小瓶包装,用于皮下注射。
每个Tecvayli 3mL单剂量小瓶含有30mg teclistamab-cqyv、乙二胺四乙酸二钠(0.054mg)、冰醋酸(0.72mg)、聚山梨醇酯20 (1.2mg)、乙酸钠(2.7mg)、蔗糖(240mg)和注射用水。
每个Tecvayli 1.7mL单剂量小瓶含有153mg teclistamab-cqyv、乙二胺四乙酸二钠(0.031mg)、冰醋酸(0.41mg)、聚山梨醇酯20 (0.68mg)、乙酸钠(1.5mg)、蔗糖(140mg)和注射用水。
【Tecvayli作用机制】
Teclistamab-cqyv是一种双特异性T细胞结合抗体,它与T细胞表面表达的CD3受体和多发性骨髓瘤细胞和一些健康B系细胞表面表达的B细胞成熟抗原(BCMA)结合。在体外,teclistamab-cqyv激活T细胞,引起各种促炎细胞因子的释放,并导致多发性骨髓瘤细胞的溶解。
【Tecvayli患者资讯资料】
1、细胞因子释放综合征(CRS):与CRS相关的体征和症状,包括发热、缺氧、寒战、低血压、窦性心动过速、头痛和肝酶升高。建议患者如果出现任何CRS迹象或症状,立即就医。
2、告知患者,在Tecvayli递增剂量方案中的所有剂量给药后,他们将住院48小时。
3、神经毒性(包括ICANS):与神经毒性(包括ICANS)相关的体征和症状,包括头痛、意识模糊、书写困难、运动功能障碍、神经病或脑病。建议患者如果出现任何神经毒性的体征或症状,应立即就医。建议患者在完成Tecvayli递增剂量方案期间和之后的48小时内,以及在出现任何新的神经毒性症状的情况下,避免驾驶或操作重型或有潜在危险的机器,直到神经毒性消失。
4、T Tecvayli只能通过一个名为REMS Tecvayli的受限程序获得。告知患者,他们将获得一张Tecvayli患者钱包卡,应始终随身携带,并向其所有医生出示。该卡描述了CRS和神经毒性的症状和体征,如果出现这些症状和体征,应提示患者立即就医。
5、肝毒性:告知患者可能出现肝酶升高,他们应报告可能表明肝毒性的症状,包括疲劳、厌食、右上腹部不适、尿黑或黄疸。
6、感染:告知患者感染的迹象和症状。
7、中性粒细胞减少症:告知患者与中性粒细胞减少症和发热性中性粒细胞减少症相关的体征和症状。
8、过敏和其他给药反应:建议患者在出现全身给药相关反应的任何体征和症状时立即就医。告知患者可能会出现局部注射部位反应,并报告任何严重反应。
9、胚胎-胎儿毒性:建议孕妇告知她们的医生是否已经怀孕或将要怀孕。告知女性对胎儿的潜在风险的生殖潜力,并在Tecvayli治疗期间和最后一次给药后的5个月内使用有效的避孕措施。
10、哺乳期:建议女性在使用Tecvayli治疗期间以及最后一次给药后的5个月内不要进行母乳喂养。
信息来源:
[1]https://www.rxlist.com/pedmark-drug.htm#description
[2]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-disco-burst-edition-fda-approval-Tecvayli
[3]https://ndclist.com/ndc/52652-8001
注:药品如有新包装,以新包装为准。以上资讯为高等医药院校的学生志愿者翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。