强生(JNJ)和艾伯维(AbbVie)近日宣布,美国食品和药物管理局(FDA)已批准靶向抗癌药Imbruvica(ibrutinib,依鲁替尼)联合利妥昔单抗(rituximab)一线治疗慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者。
这一里程碑标志着自2013年首次批准以来,依鲁替尼Imbruvica在5种B细胞血液癌症以及慢性移植物抗宿主病(cGVHD)在内总共6种疾病领域获得了11项FDA批准:伴或不伴17p删除突变(del17p)的慢性淋巴细胞白血病(CLL)、伴或不伴17p删除突变(del17p)的小淋巴细胞淋巴瘤(SLL)、Waldenstrom巨球蛋白血症(WM)、既往已接受治疗的套细胞淋巴瘤(MCL)、需要系统治疗并且至少接受过一种抗CD20疗法的边缘区淋巴瘤(MZL)、对一种或多种系统疗法治疗失败的慢性移植物抗宿主病(cGVHD)。其中,CLL是成年人群体中最常见的白血病类型。
此次批准通过FDA的实时肿瘤学审查(RTOR)试点项目、Orbis项目、优先审查程序获得批准。Imbruvica是一种每日口服一次的首创布鲁顿酪氨酸激酶(BTK)抑制剂,由艾伯维旗下公司Pharmacyclics与强生旗下杨森生物技术公司联合开发和商业化。截至目前,Imbruvica在已批准的适应症中被用于治疗全球超过19.5万名患者。
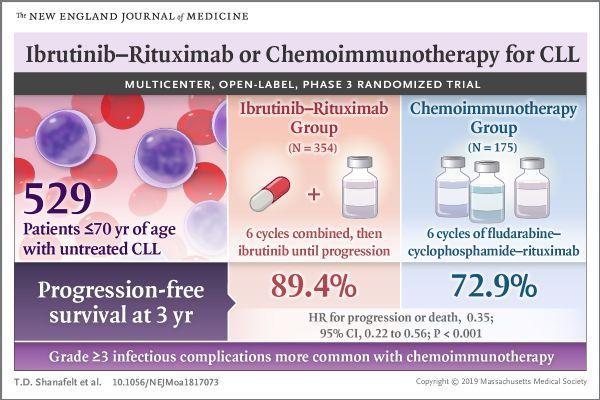
此次最新批准,基于III期E1912研究(NCT02048813)的结果。该研究共评估了529例年龄≤70岁、先前未接受治疗的CLL患者。研究中,这些患者随机分配接受依鲁替尼Imbruvica+利妥昔单抗治疗方案(n=354)或化学免疫治疗方案FCR(氟达拉滨+环磷酰胺+利妥昔单抗,n=175)。主要终点是无进展生存期(PFS)、次要终点是总生存期(OS)。
结果显示,与FCR治疗组相比,依鲁替尼Imbruvica+利妥昔单抗治疗组PFS和OS均显著提高。研究中的安全性数据与依鲁替尼Imbruvica已知的安全性特征一致。
依鲁替尼Imbruvica是一种每日口服一次的小分子药物,主要通过阻断癌细胞增殖和转移所需的布鲁顿酪氨酸激酶(BTK)发挥抗癌作用。BTK是B细胞受体信号复合物中的一个关键信号分子,在恶性B细胞的存活和转移以及其他多种严重致衰性疾病中发挥了重要作用。
Imbruvica依鲁替尼能够阻断介导B细胞不受控制地增殖和扩散的信号通路,帮助杀死并降低癌细胞数量,延缓癌症的恶化。在临床试验中,单药及组合疗法针对广泛类型的血液系统恶性肿瘤展现出了强大的疗效。
原文出处:https://www.prnewswire.com/news-releases/us-fda-approves-imbruvica-ibrutinib-plus-rituximab-for-the-treatment-of-patients-with-chronic-lymphocytic-leukemia-cll-301044670.html
以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。