武田制药(Takeda)近日宣布,美国食品和药物管理局(FDA)已受理TAK-721的新药申请(NDA)并授予了优先审查。TAK-721是一种布地奈德口服混悬液,这是布地奈德的一种新型粘附性局部活性口服粘性制剂,专为治疗嗜酸性食管炎(EoE)而设计的。
TAK-721是布地奈德的一种新型口服粘性制剂,它能够局部粘附在粘膜上,从而在食道部位产生活性,是针对EoE特别设计的配方。布地奈德是一种糖皮质激素,它的其它配方类型已经被用于治疗哮喘、慢性阻塞性肺病、过敏性鼻炎和鼻息肉等炎症性疾病。
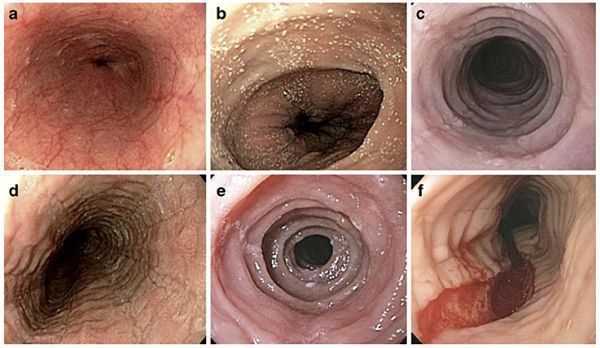 嗜酸性食管炎
嗜酸性食管炎
如果获得批准,TAK-721将成为FDA批准的第一款治疗这种慢性炎症性疾病的药物,武田计划使用品牌名Eohilia(布地奈德口服混悬液)进行销售。美国FDA通常会对在批准后有潜力在安全性或有效性方面与当前疗法相比有重大进展的药物给予优先审查。此前,FDA已授予TAK-721突破性药物资格(BTD)和孤儿药资格(ODD)。
TAK-721开发项目是美国报告结果的第一个也是最大规模的EoE 3期临床试验项目。NDA基于关键3期试验ORBIT1和ORBIT2的数据,这些试验研究了TAK-721在青少年和成人(11-55岁)EoE患者中的安全性和有效性。试验结果显示TAK-721能够显著提高患者的组织学应答率和显著降低嗜酸性粒细胞计数。
EoE是一种可导致食道损伤的慢性炎症性疾病。在美国,大约每2000人中就有1人患有EoE,该病的患病率正在上升。虽然确切的病因尚不清楚,但EoE涉及基因、环境因素、免疫系统功能紊乱的相互复杂作用。EoE的慢性炎症可导致一系列症状,这些症状可能因人和年龄而异,但最常见的结果是吞咽困难。如果不治疗,EoE会随着时间的推移而恶化,并导致食道损伤和炎症。在严重情况下,EoE可导致食管狭窄,可能导致食物卡住。
原文出处:U.S. Food and Drug Administration Accepts New Drug application for Review, Grants Priority Review for Takeda’s TAK-721 (budesonide oral suspension) for the Treatment of Eosinophilic Esophagitis
以上是关于(武田抗癌新药TAK-721(布地奈德口服混悬液)治疗嗜酸性食管炎(EoE)获FDA优先审查)的最新资讯,如需了解TAK-721(布地奈德口服混悬液)更多资讯,可以直接联系我们药师客服。
以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。




