近日,欧洲药品管理局宣布已有条件批准COLUMVI(注射用glofitamab,中文译名:格菲妥单抗),用于治疗接受过两线或多线全身治疗且不符合或不能接受CAR-T细胞治疗或之前接受过CAR-T细胞治疗的未另作说明的复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(trFL)引起的弥漫性大 B 细胞淋巴瘤或原发性纵隔B细胞淋巴瘤(PMBCL)的成年患者。
该批准为有条件的上市许可,正在等待试验结果以验证其临床益处。
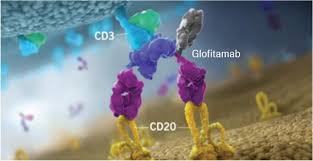
COLUMVI是一种能够同时靶向CD3与CD20的双特异性单克隆抗体,是欧洲首例通过靶向T细胞和B细胞治疗弥漫性大B细胞淋巴瘤的药物。通过结合这两个靶点,COLUMVI激活T细胞,使其增殖,并导致癌变B细胞快速分解。
批准是基于非盲、I/II期、多中心、多队列试验(NP30179)的积极结果,该试验旨在评估COLUMVI作为复发或难治性B细胞淋巴瘤患者的单一疗法。
在单组弥漫性大B细胞淋巴瘤队列(n=108)中,84.3%的患者对其最近的治疗无效,约三分之一(34.3%)之前接受过CART细胞治疗。
主要疗效结果指标是由IRC使用2014年Lugano应答标准评估的完全应答(CR)率。
结果显示,35.2%的患者(n=38/108)达到完全缓解(CR;所有癌症迹象消失),50.0%(n=54/108)达到客观缓解(OR;CR的组合或部分应答,其体内癌症量的减少)。在获得完全缓解的患者中,74.6%的患者在12个月时仍有反应,而未达到完全缓解的中位持续时间。
安全性方面,最常见的副作用是细胞因子释放综合征、感染、中性粒细胞减少症、贫血、血小板减少症、肿瘤发作、头痛、便秘、腹泻、恶心、皮疹、发热、低磷酸盐血症、低镁血症、低钙血症和低钾血症。
注:以上内容仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。