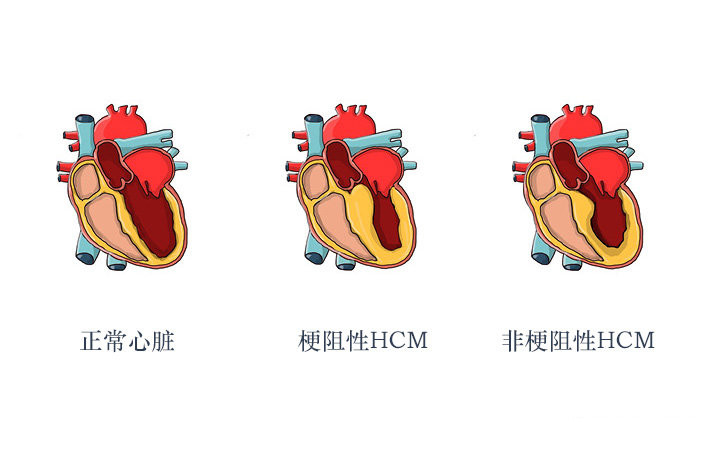
在2023年欧洲心脏病学会(ESC)大会上,玛伐凯泰(商品名:CAMZYOS,通用名:mavacamten)在梗阻性肥厚型心肌病(HCM)中的作用备受关注。大会上提出的三项研究和新指南强调了肥厚型心肌病治疗方面的进展,特别是使用玛伐凯泰。
“ESC提供的新长期数据与每项研究的主要分析一致,进一步强调了我们的首创疗法可以为症状性梗阻性HCM患者带来的益处。”百时美施贵宝公司副总裁兼心肌病和心力衰竭临床开发负责人医学博士Amy Sehnert说道。“这些积极的数据强化了这两项3期试验的临床意义,促使CAMZYOS在美国、欧盟和全球其他国家获得批准。”
玛伐凯泰是一种心肌肌球蛋白选择性的别构可逆性抑制剂。玛伐凯泰调节能进入“可结合肌动蛋白”(产生收缩力)状态的肌球蛋白头的数量,从而减少动力产生(收缩期)和残留(舒张期)横桥形成的概率。过量的肌球蛋白-肌动蛋白横桥的形成和超松弛状态的失调是HCM的机理特征 。玛伐凯泰将整体肌球蛋白群转变到节能、可募集的超松弛状态。在HCM患者中,用玛伐凯泰抑制肌球蛋白可减少动力性左心室流出道(LVOT)梗阻并改善心脏充盈压。
玛伐凯泰/mavacamten是首个且目前唯一获得美国FDA批准的心肌肌球蛋白抑制剂,适用于治疗有症状的纽约心脏协会(NYHA)心功能II-III级的梗阻性肥厚型心肌病(oHCM)成人患者,以改善功能能力和症状。同时其在欧盟获批用于治疗有症状的NYHA心功能II-III级的梗阻性肥厚型心肌病(oHCM)成人患者。
在中国,于去年2月获得了突破性疗法资格认定,用于治疗oHCM患者。今年4月,玛伐凯泰用于治疗有症状的oHCM成人患者的新药上市申请(NDA)已被中国国家药品监督管理局(NMPA)受理,并被纳入优先审评。
目前,该药也在澳大利亚、巴西、加拿大、英国、中国澳门特别行政区、新加坡、韩国和瑞士获得了监管部门的上市批准。
VALOR-HCM研究
VALOR-HCM是一项双盲、安慰剂对照、随机临床试验,安慰剂交叉时间为16岁,旨在评估玛伐凯泰对转诊接受间隔缩小治疗(SRT)的症状性梗阻性HCM患者的疗效和安全性。
该试验的主要终点是第56周时接受SRT、仍符合指南资格或无法评估SRT状态的患者比例。该试验招募了112名患有高度症状的梗阻性HCM患者。其中108人被认为有资格参加为期56周的评估。
试验结果表明,最初的玛伐凯泰组中8.9%的患者和安慰剂交叉组中19.2%的患者达到了复合终点。在最初的玛伐凯泰组中,3例接受了SRT,1例符合SRT条件,1例无法进行SRT评估。在安慰剂交叉组中,3人接受了SRT,4人符合SRT条件,3人无法评估SRT。总体而言,108名患者中有96名继续长期服用玛伐凯泰。
MAVA-LTE研究
对完成EXPLORER-HCM试验的患者进行长期随访。在ESC2023年大会分析中,主要研究员Pablo García-Pavia医学博士提出了对该队列长达120周随访的累积分析。
231名患者参加了MAVA-LTE EXPLORER队列。数据截止时,队列的中位研究时间为101周。截至数据截止时,仍有215名患者仍在接受治疗,总调整暴露量为475患者年。
达到第120周的80名患者的玛伐凯泰剂量为:2.5mg(27.5%);5mg(31.3%);10mg(26.3%);15mg(12.5%)。从第48周到第120周,14.7%的患者接受了剂量调整。
结果表明,玛伐凯泰治疗与从初始到第120周LVOT梯度(静止时,35.3[33.0]mmHg;Valsalva 47.0 [37.3] mmHg)、左心房容积指数(−8.5 [10.3] mL/m²)和E/e '平均值(−3.9 [5.0])的平均[SD]变化的持续改善有关。在第120周时,83.5%的受试者的Valsalva LVOT梯度等于或大于30mmHg。
玛伐凯泰/Mavacamten在中国患者中的应用
EXPLORER-CN试验的启动是为了解决玛伐凯泰在亚洲人群中缺乏治疗效果的证据,该试验被设计为一项3期随机、双盲、安慰剂对照临床试验,试验对象为来自中国12家医院的81名患者。
本试验纳入的患者需要有梗阻性HCM、LVOT压差≥50mmHg以及NYHAII级或III级症状,并接受30周治疗。主要终点是Valsalva LVOT峰值梯度从起始至第30周的变化。
治疗30周后与安慰剂相比的Valsalva LVOT峰值梯度(最小二乘均差,-70.29mmHg;95%CI,-89.64至-50.94;P<0.001)。
在第30周,与安慰剂组相比,玛伐凯泰组NT-proBNP的减少量增加了82%(几何平均比[GMR]的比例,0.18;95%CI,0.13至0.24),hs-cTnI的减少量增加了66%(GMR比例,0.34;95%CI,0.27至0.42)。
ESC指南中的玛伐凯泰
在2023年ESC大会期间,ESC发布了第一份涵盖所有心肌病亚型的国际指南。这也是第一次对除HCM以外的心肌病提出具体建议。
该新指南包含2条关于使用玛伐凯泰的建议:
IIa类别,A级:心脏肌球蛋白ATP酶抑制剂(玛伐凯泰)在LVEF超声心动图监测下滴定至最大耐受剂量,应考虑与β-受体阻滞剂联合使用,以改善成人静息或激发左心室流出道梗阻的症状。
IIa类别,B级:心脏肌球蛋白atp酶抑制剂(玛伐凯泰)可通过超声心动图监测LVEF滴定至最大耐受剂量,对于有静息或诱发的左心室流出道梗阻,且不耐受β受体阻滞剂、维拉帕米/地尔硫卓或丙吡胺禁忌证的有症状成人,应考虑作为单药治疗。
以上就是2023年ESC大会上提出的与玛伐凯泰相关的三项研究和新指南,其中两项研究详细说明了使用的长期影响、一项单一研究证明中国患者受益,以及包括玛伐凯泰的IIa级建议的心肌疾病的新指南更新。
参考来源:
【1】‘Long-term follow-up data from two phase 3 studies of CAMZYOS® (mavacamten) demonstrate consistent and durable response in patients with symptomatic obstructive hypertrophic cardiomyopathy (HCM)’,新闻稿。Bristol Myers Squibb;2023年8月28日发布。
【2】‘Desai MY, Owens A, Wolski K, et al. Mavacamten in Patients With Hypertrophic Cardiomyopathy Referred for Septal Reduction: Week 56 Results From the VALOR-HCM Randomized Clinical Trial’,《JAMA Cardiol》。2023年8月28日在线发布。doi:10.1001/jamacardio.2023.3342
【3】Tian Z, Li L, Li X, 等人。‘Effect of Mavacamten on Chinese Patients With Symptomatic Obstructive Hypertrophic Cardiomyopathy: The EXPLORER-CN Randomized Clinical Trial’,《JAMA Cardiol》。2023 年 8 月 28 日在线发布。doi:10.1001/jamacardio.2023.3030
【4】Arbelo E、Protonotarios A、Gimeno JR 等人。‘2023 ESC Guidelines for the management of cardiomyopathies [印刷前在线发布,2023 年 8 月 25 日]’,《Eur Heart J》2023;ehad194。doi:10.1093/eurheartj/ehad194
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。