根据FDA官网显示,2023年11月已对多款新分子实体、新适应症以及重组融合蛋白的批准做出监管决定,其中包括治疗HR阳性晚期乳腺癌、进展性硬纤维瘤、慢性体重管理等。
一、心血管疾病
商品名:Adzynma
适应症:先天性血栓性血小板减少性紫癜(cTTP)
研发公司:武田制药
据武田公司11月9日宣布,美国食品药品监督管理局(FDA)已批准Adzynma(ADAMTS13,recombinant-krhn),前称TAK-755,用于先天性血栓性血小板减少性紫癜(cTTP)成人和儿科患者的预防性或按需酶替代疗法(ERT)。
据武田称,Adzynma是第一个也是唯一一个获得FDA批准的重组ADAMTS13蛋白,旨在通过替换缺陷的ADAMTS13酶来解决cTTP患者未满足的医疗需求。
cTTP是由于ADAMTS13缺陷所致。这导致血液中超大冯·维勒布兰德因子(VWF)多聚体的积累以及不受控制的血小板聚集和粘附。ADAMTS13是一种VWF裂解蛋白酶,具有血小板反应蛋白基序13的解整合素和金属蛋白酶。Adzynma是ADAMTS13蛋白的纯化重组形式,旨在替代缺失或缺陷的ADAMTS13酶。
该药物被批准作为每周或每隔一周一次的静脉输注用于预防,以及每日一次的输注用于按需治疗急性事件 。这与当前基于血浆的治疗相比,减少了给药时间和剂量。
血浆输注需要更长的时间,在急性病例中,需要持续输注直到血液检查和症状改善,这可能需要住院数天甚至数周。另外,还可能导致严重的并发症,包括容量超负荷(当体内血量过高并对心脏造成压力时),以及过敏反应。
武田表示该药物将于12月上市。与此同时,该药物还在进行其他适应症的试验,包括获得性或免疫介导的血栓性血小板减少性紫癜(iTTP)的2期研究和镰状细胞病的1期研究。
二、胃、肝脏疾病
商品名:Voquezna
适应症:侵蚀性食管炎和相关的胃灼热
研发公司:Phathom Pharmaceuticals, Inc.
据Phathom Pharmaceuticals, Inc.11月1日宣布,美国食品药品监督管理局(FDA)已批准Voquezna (vonoprazan) 片剂,作为治疗成人各种侵蚀性食管炎(也称为侵蚀性GERD(胃食管反流病))的新疗法,维持各种侵蚀性GERD的愈合,并缓解与侵蚀性GERD相关的胃灼热。
vonoprazan是一种新型钾竞争性酸阻滞剂(PCAB);Voquezna是第一个在美国获得批准的PCAB。该药物已显示出抑制胃酸的潜力,从而达到对提高治疗效果至关重要的pH水平。目前以片剂10mg,20mg的规格获批。
Voquezna于2022年5月3日首次获得FDA批准,名称为Voquezna Triple和Dual Pak,用于治疗幽门螺杆菌(H. pylori ) 成人感染。注意的是,Voquezna Triple是一种共同包装的产品,含有vonoprazan、阿莫西林(一种青霉素类抗生素)和克拉霉素(一种大环内酯类抗菌剂);Voquezna Dual Pak则是一种包含vonoprazan和阿莫西林的联合包装产品。
同时,此次批准也标志着30多年来美国侵蚀性GERD市场的首次重大创新。
三、血液疾病
商品名:Ryzneuta
适应症:化疗引起的中性粒细胞减少症
研发公司:Evive Biotech(亿一生物)
Evive Biotech(亿一生物)和Acrotech Biopharma联合宣布,美国食品药品监督管理局(FDA)于11月16日宣布已批准Ryzneuta (Efbemalenograstim alfa,前称:F-627),可用于降低患有非髓系恶性肿瘤的成年患者的感染发病率,表现为发热性中性粒细胞减少症,这些患者正在接受骨髓抑制性抗癌药物治疗,并伴有临床显著的发热性中性粒细胞减少症发病率。
Ryzneuta是一种新型的长效粒细胞集落刺激因子(G-CSF),可以刺激中性粒细胞前体细胞的增殖、分化和释放。有助于增强癌症患者的免疫功能,预防化疗引起的中性粒细胞减少的副作用。
这是由中国亿帆医药控股子公司亿一生物研发的生物创新药,在中国,Ryzneuta于今年5月以商品名亿立舒批准上市。根据新闻稿,此次Ryzneuta在美获批,使其成为中国境内首款同时在中国、美国获批的长效粒细胞集落刺激因子(G-CSF)产品。
四、免疫接种
商品名:Ixchiq
适应症:基孔肯雅病毒
研发公司:Valneva
11月10日,美国食品药品监督管理局(FDA)已加速批准Ixchiq(前称VLA1553)作为首个基孔肯雅疫苗,用于暴露于基孔肯雅病毒(CHIKV)风险增加的18岁及以上人群。根据抗CHIKV中和抗体滴度,该适应症已获得加速批准。该适应症的继续批准取决于在确认性研究中对临床益处的验证。
Ixchiq是一种减毒活疫苗,通过肌肉注射以单剂量给药,旨在删除CHIKV基因组的一部分。该疫苗含有活的、弱化的基孔肯雅病毒,并可能在疫苗接种者中引起与基孔肯雅病患者相似的症状。
研发公司Valneva称,Ixchiq是全球第一个获得许可的基孔肯雅疫苗,以解决这一未满足的医疗需求。
五、传染病
商品名:DefenCath
适应症:预防透析患者导管相关血流感染
研发公司:CorMedix
据CorMedix公司11月15日宣布,美国食品药品监督管理局(FDA)已批准DefenCath(taurolidine/heparin,牛磺罗定/肝素)导管封管液,用于降低通过中心静脉导管(CVC)接受长期血液透析的肾功能衰竭成年患者有限人群中导管相关血液感染(CRBSI)的发生率。预计将于2024年第一季度上市。
注意的是,该药物仅适用于通过CVC接受长期血液透析的肾衰竭成年患者。对适应症之外的其他人群的安全性和有效性尚未确定。
DefenCath由两种不同的药物组成。第一种是抗凝剂溶液肝素,通常在不使用导管时用于导管,以防止潜在危险的血栓形成。第二种是CorMedix公司研发的一种噻二嗪类抗菌剂牛磺罗定,可作为广谱抗菌剂对抗多种细菌。此外,微生物对牛磺罗定的耐药性尚未在欧洲的实验室或临床使用中得到证实,这可能是由于其化学作用机制。
牛磺罗定已被证明对以下微生物具有活性:金黄色葡萄球菌(包括甲氧西林敏感金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌)、表皮葡萄球菌、粪肠球菌、大肠杆菌、肺炎克雷伯菌、铜绿假单胞菌、粘质沙雷菌、白色念珠菌、光滑念珠菌。
目前,该药物已在欧洲和其他地区以Neutrolin商品名上市。值得一提的是,DefenCath是美国第一个也是唯一一个获得FDA批准的抗菌导管封管解决方案。
六、代谢紊乱
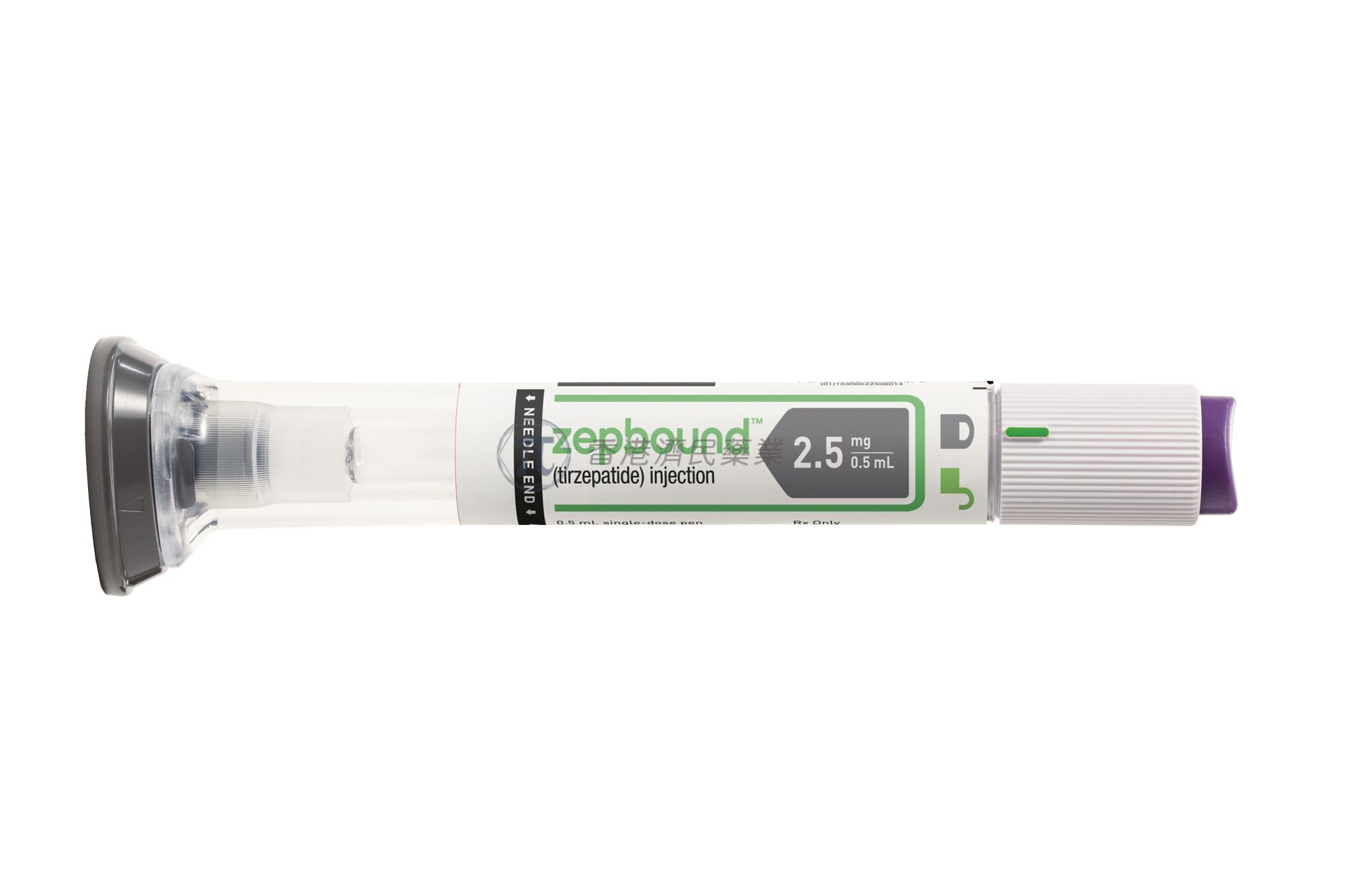
商品名:Zepbound
适应症:慢性体重管理
研发公司:礼来
据礼来公司11月8日的新闻稿,美国食品药品监督管理局(FDA)已批准其Zepbound (tirzepatide,替西帕肽)注射液上市,作为低热量饮食和增加体力活动的辅助药物,用于初始体重指数(身体质量指数)为30kg/m2或以上(肥胖)的成年人的慢性体重管理;或27kg/m2或更高(超重),同时存在至少一种与体重相关的共病(如高血压、二型糖尿病糖尿病、血脂异常、阻塞性睡眠呼吸暂停或心血管疾病)。预计将于今年年底在美国上市。
公司指出,该药物还应与低热量饮食和增加体力活动一起使用。Zepbound不应与其他含替西肽的产品或任何GLP-1受体激动剂药物一起使用,并且尚未对有胰腺炎病史或患有严重胃肠道疾病(包括严重胃轻瘫)的患者进行研究。
Zepbound包含tirzepatide,一种葡萄糖依赖性促胰岛素多肽(GIP)受体和胰高血糖素样肽-1 (GLP-1)受体激动剂。2022年5月,Tirzepatide以商品名Mounjaro获得FDA的首肯,作为饮食和锻炼的辅助药物,用于改善患有二型糖尿病病的成人的血糖控制。
此次批准,代表着Zepbound是FDA批准的第一个也是唯一一个激活GIP(葡萄糖依赖性促胰岛素多肽)和GLP-1(胰高血糖素样肽-1)激素受体的肥胖治疗药物。
七、肌肉骨骼疾病
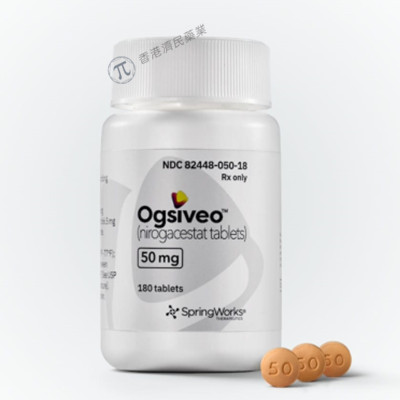
适应症:硬纤维瘤
研发公司:SpringWorks Therapeutics,Inc.
SpringWorks Therapeutics,Inc.于11月27日宣布美国食品药品监督管理局(FDA)已批准其口服γ分泌酶抑制剂Ogsiveo(nirogacestat)片剂,用于治疗需要全身治疗的进行性硬纤维瘤成年患者。
除上述适应症之外,该药物在美国尚未被批准用于任何其他适应症的治疗,也未被任何其他卫生机构批准用于任何其他司法管辖区的任何适应症。
Ogsiveo是一款口服特异性γ-分泌酶小分子抑制剂,通过抑制γ分泌酶发挥作用,γ分泌酶是一种负责激活Notch信号蛋白的酶。 这种蛋白质被认为在刺激硬纤维瘤的生长中发挥着至关重要的作用。 通过阻断这种酶活性,Ogsiveo可以有效地抑制肿瘤进展。
该药物曾获得FDA授予快速通道资格、突破性疗法认定与优先审评资格,用以治疗进行性、不可切除复发或难治性硬纤维瘤或深部纤维瘤病成人患者。新闻稿指出,Ogsiveo是该公司的第一个商业产品,也是FDA批准的第一个专门用于韧带样瘤的药物。
八、肿瘤疾病
适应症:局部晚期或转移性ROS1阳性NSCLC
研发公司:Bristol Myers Squibb(百时美施贵宝)
Bristol Myers Squibb(百时美施贵宝)制药公司于11月15日宣布美国食品药品监督管理局(FDA)已批准Augtyro (repotrectinib,中文名:瑞普替尼),用于治疗患有局部晚期或转移性ROS1阳性非小细胞肺癌(NSCLC)的成年患者。
Augtyro是一种针对ROS1致癌融合的酪氨酸激酶抑制剂(TKI),也是第二代靶向ROS1或NTRK阳性局部晚期或转移性实体瘤的新型TKI,旨在提高缓解率并延长缓解时间,并具有良好的颅内活性。
该药物作为口服疗法给药,剂量为160mg,每日一次,持续14天,然后增加至160mg,每日两次,直到疾病恶化或出现不可接受的毒性。
商品名:Fruzaqla
适应症:难治性转移性结直肠癌
研发公司:武田制药
武田制药公司(Takeda)于11月9日宣布,美国食品药品监督管理局(FDA)批准Fruzaqla(fruquintinib,中文名:呋喹替尼)的上市申请,用于治疗既往曾接受过氟尿嘧啶类、奥沙利铂和伊立替康为基础的化疗、抗血管内皮生长因子("VEGF")治疗,以及抗表皮生长因子受体(EGFR)治疗(若属RAS野生型及医学上适用)的成人转移性结直肠癌(mCRC)患者。
呋喹替尼是和黄医药自主研发的、具有完全自主知识产权的抗癌药物。2023年1月,和黄医药将呋喹替尼在中国以外地区的许可权益授权给武田制药,武田拥有全球独家许可在中国以外的全球范围内推进呋喹替尼针对所有适应症的开发、商业化和生产。
Fruzaqla(呋喹替尼)是一种选择性的口服VEGFR-1、-2及-3抑制剂。VEGFR抑制剂在抑制肿瘤的血管生成中起到至关重要的作用。FRUZAQLA被设计为拥有更高的激酶选择性,旨在降低脱靶激酶活性,从而实现更高的药物暴露、对靶点的持续覆盖以及当潜在作为联合疗法时拥有更高的灵活度。
在中国,Fruquintinib于2018年9月获得中国国家医疗产品管理局(NMPA)批准上市,并于2018年11月在中国以商品名ELUNATE上市。FDA指出,Fruzaqla是第一个也是唯一一个在美国批准用于既往治疗过的mCRC的所有三种VEGF受体激酶的选择性抑制剂,无论生物标志物状态如何。
商品名:Keytruda
适应症:局部晚期不可切除或转移性胆道癌
研发公司:默沙东(MSD)
11月1日,默沙东(MSD)宣布美国FDA已批准其重磅PD-1抑制剂Keytruda(pembrolizumab,可瑞达)与吉西他滨和顺铂联用,用于治疗局部晚期不可切除或转移性胆道癌(BTC)患者。根据新闻稿,这是Keytruda在治疗胃肠道癌症获批的第六个适应症。
Keytruda作为一种人源化的抗PD-1单克隆抗体,可以阻断PD-1与其配体PD-L1、PD-L2的结合,进而激活T淋巴细胞。此作用可能增强体内免疫系统侦测与抵抗肿瘤细胞的能力。2014年9月,Keytruda首次获FDA批准治疗晚期黑色素瘤,并在后续获批作为一线疗法治疗转移性NSCLC患者。
在中国,Keytruda也已获批多项适应症,涵盖黑色素瘤、非小细胞肺癌、头颈部鳞状细胞癌、结直肠癌、食管癌、肝癌等。
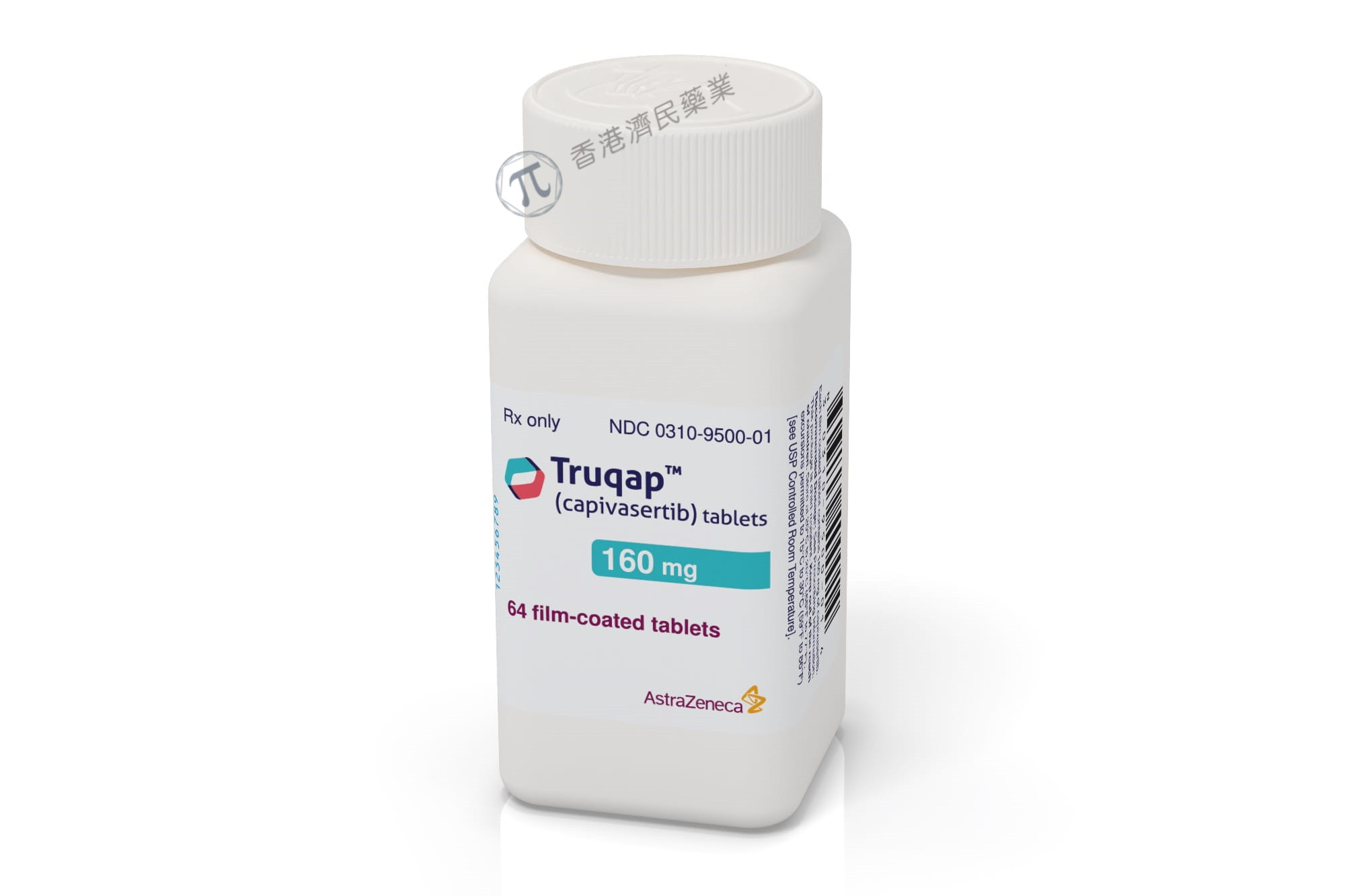
适应症:晚期HR阳性乳腺癌
研发公司:阿斯利康
据阿斯利康公司11月16日宣布,美国食品药品监督管理局(FDA)已批准Truqap(capivasertib)与Faslodex(氟维司群)联合用于治疗激素受体(HR)阳性、人类表皮生长因子受体2 (HER2)阴性、局部晚期或转移性乳腺癌的成年患者,根据FDA批准的试验检测,这些患者患有一种或多种PIK3CA/AKT1/PTEN突变,在转移性疾病中接受至少一种基于内分泌的方案治疗后进展,或在完成辅助治疗后12个月内复发。
在批准的同时,FDA还批准了FoundationOne CDx检测作为检测这些相关变化(PIK3CA、AKT1和PTEN)的辅助诊断。
Truqap是一种口服选择性三磷酸腺苷(ATP)竞争性抑制剂,可抑制丝氨酸/苏氨酸激酶AKT (AKT 1/2/3)的所有3种亚型,该药物旨在靶向AKT1基因突变来发挥作用,AKT1基因突变是肿瘤生长和增殖的原因。
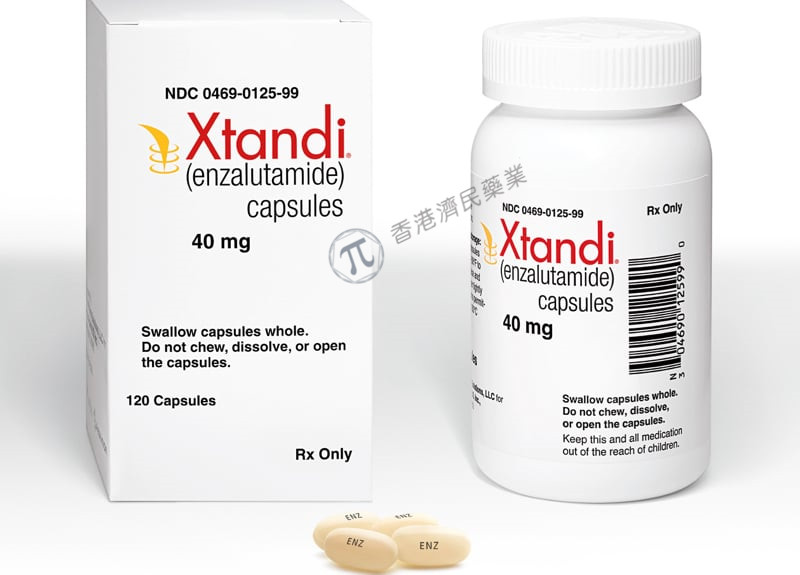
适应症:晚期HR阳性乳腺癌
研发公司:Astellas Pharma Inc.
11月16日,美国食品药品监督管理局(FDA)已批准Xtandi(安可坦,通用名:恩扎卢胺,enzalutamide)的补充新药申请(sNDA ),用于治疗具有高转移风险(高风险BCR)的生化复发的非转移去势敏感性前列腺癌(nmCSPC)患者。在此之前,Xtandi也被批准用于治疗去势抵抗性前列腺癌和转移性去势敏感前列腺癌患者。
Xtandi是一种雄激素受体信号传导抑制剂,每日口服一次。Xtandi直接靶向雄激素受体(AR),并在AR信号传导途经的三个步骤中发挥作用:(1)抑制雄激素结合——雄激素结合诱导构象变化可触发受体激活;(2)防止核移位——AR移位至核是AR介导的基因调控中必不可少的步骤;(3)削弱DNA结合——AR与DNA的结合对于调控基因表达至关重要。
随着这一批准,Xtandi成为FDA批准的首个也是唯一一个用于治疗具有高转移风险(高风险BCR)的生化复发的非转移性去势敏感前列腺癌(nmCSPC)患者的雄激素受体信号抑制剂。
以上就是对今年11月FDA批准的所有新药作出简单汇总。
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。