罗氏(Roche)近日宣布,美国食品和药物管理局(FDA)已授予mosunetuzumab突破性药物资格(BTD),该药是一种T细胞结合CD20xCD3双特异性抗体,用于治疗先前至少接受过2种系统疗法治疗的复发性或难治性(R/R)滤泡性淋巴瘤(FL)成人患者。
FDA授予mosunetuzumab BTD,基于在I/Ib期GO29781研究(NCT02500407)中观察到的令人鼓舞的疗效结果。该研究是一项多中心、开放标签、剂量递增I/Ib期研究,评估了mosunetuzumab在复发或难治性B细胞非霍奇金淋巴瘤(R/R B-NHL)患者中的安全性和药代动力学。该研究入组的患者包括接受CAR-T细胞疗法后病情复发或对CAR-T细胞疗法有抵抗力的患者,这类患者的治疗选择有限。研究的目的是评估最佳客观缓解率(ORR,采用修订的国际工作组标准评估)、最大耐受剂量和耐受性。
去年底,在2019年美国血液学会年会(ASH2019)上公布的结果显示,mosunetuzumab表现出令人鼓舞的疗效:(1)ORR方面,惰性NHL患者中为62.7%(n=42/67),侵袭性NHL患者中为37.1%(n=46/124)。(2)完全缓解率(CR)方面,惰性NHL患者中为43.3%(n=29/67),侵袭性NHL患者中为19.4%(n=24/124)。(3)CR显示出持久性,惰性NHL患者中有82.8%(n=24/29)在初始治疗后26个月仍处于缓解状态,侵袭性NHL患者中有70.8%(n=17/24)在初始治疗后16个月仍处于缓解状态。(4)在先前接受过CAR-T细胞疗法治疗的患者中,ORR为38.9%(n=7/18),CR为22.2%(n=4/18)。(5)不良反应方面,有28.9%的患者出现细胞因子释放综合征(CRS),其中20.0%为1级、1.1%为3级,3级神经系统不良事件发生在3.7%的患者中。
BTD是FDA在2012年创建的一个新药评审通道,旨在加快开发及审查用于治疗严重或威及生命的疾病并且有初步临床证据表明该药与现有治疗药物相比能够实质性改善病情的新药。获得BTD的药物,在研发时能得到包括FDA高层官员在内的更加密切的指导,保障在最短时间内为患者提供新的治疗选择。
罗氏首席医疗官兼全球产品开发负责人Levi Garraway医学博士表示:“我们很高兴FDA授予mosunetuzumab突破性药物资格,这表明该机构认可了这款药物的早期疗效数据以及FL领域仍存在未满足的医疗需求。事实上,我们对CD20xCD3双特异性抗体(mosunetuzumab和glofitamab)在难治性淋巴瘤临床开发中的潜力感到兴奋,并继续致力于开发创新疗法,以改善患者的预后。”
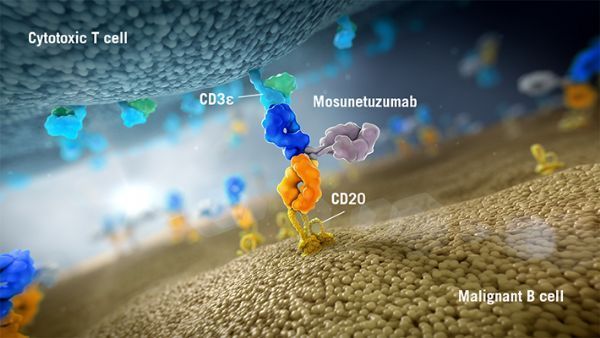
mosunetuzumab和glofitamab(前称CD20-TCB)均为CD20xCD3 T细胞结合双特异性抗体,靶向B细胞表面的CD20和T细胞表面的CD3。这种双重靶向可激活和重新定向患者现有的T细胞,通过向B细胞内释放毒性蛋白来消除目标B细胞。
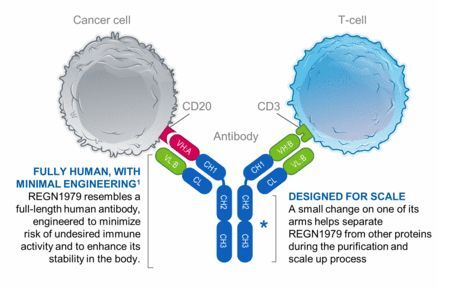
2款抗体在结构上有所不同,mosunetuzumab结构类似于人天然抗体,但含有2个Fab区,其中一个Fab区靶向CD20,另一个Fab区靶向CD3。glofitamab具有一种“2:1”的新颖结构模式,含有2个靶向CD20的Fab区,一个靶向结合CD3的Fab区。这2款抗体是罗氏探索数个双特异性抗体模式策略的一部分,以确定对于患者而言具有最大化潜在临床益处的方案。目前,罗氏正在开发mosunetuzumab和glofitamab作为单药疗法以及联合其他药物,治疗CD20阳性的B细胞非霍奇金淋巴瘤,包括弥漫性大B细胞淋巴瘤和滤泡性淋巴瘤。
7月初,REGN1979的5项临床试验申请获国家药监局(NMPA)药品审评中心(CDE)受理。REGN1979已被美国FDA授予孤儿药资格(ODD),用于治疗弥漫性大B细胞淋巴瘤(DLBCL)和滤泡性淋巴瘤(FL)。REGN1979目前正在晚期FL、DLBCL和其它淋巴瘤患者中进行一项I期临床研究和一项可能成为注册试验的II期临床研究。
REGN1979的临床I期研究阳性数据结果已在ASH2019会议上公布。数据显示,REGN1979单药治疗复发或难治性弥漫性大B细胞淋巴瘤(R/R DLBCL),高剂量显示出增加的疗效:接受80/160/320mg治疗的8例患者中有5例病情实现完全缓解(CR),接受CAR-T治疗失败的3例患者中有2例实现CR。
此外,REGN1979单药治疗复发或难治性滤泡性淋巴瘤(R/R FL)也显示出随剂量增加疗效增加:接受≥5mg治疗的14例患者中有13例病情缓解,总缓解率(ORR)高达93%(n=13/14)、完全缓解率(CR)达71.4%(n=10/14)。
原文出处:FDA grants Breakthrough Therapy Designation for Roche’s CD20xCD3 bispecific cancer immunotherapy mosunetuzumab recognising its potential in follicular lymphoma
以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。




