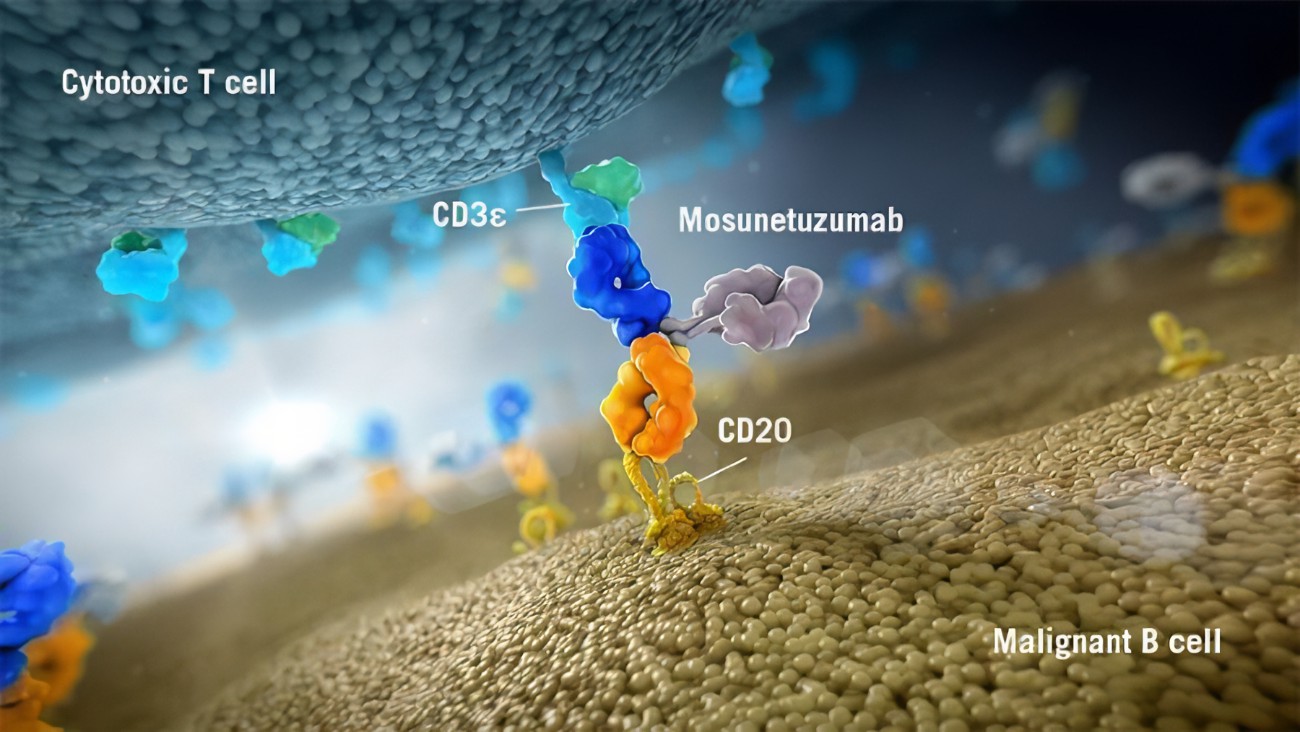
2022年6月8日,罗氏公司新闻稿宣布欧盟委员会已授予CD20xCD3T细胞结合双特异性抗体Lunsumio(mosunetuzumab)有条件上市许可,用于治疗至少接受过两种既往系统治疗的复发性或难治性(R/R)滤泡型淋巴瘤(FL)成年患者。这是一种现成的疗法,随时可供,所以人们不必等待即可开始治疗
Lunsumio是首创的CD20xCD3 T细胞结合双特异性抗体,旨在靶向B细胞表面的CD20和T细胞表面的CD3。这种双重靶向激活并重定向患者现有的T细胞,通过将细胞毒性蛋白释放到B细胞中来接合和消除目标B细胞。
该批准是基于I/II期GO29781研究(NCT02500407)的积极结果,其中Lunsumio表现出高完全应答率,大多数完全应答者维持反应至少18个月,并且对接受过大量预处理的FL患者具有良好的耐受性。中位随访18.3个月后,应答者的中位应答持续时间为22.8个月(95%CI:9.7-不可估计),完全应答率为60%(n=54/90),客观应答率为80%(n=72/90)。
“对于滤泡性淋巴瘤患者来说,如果之前的多种治疗方法都失败了,那么为他们提供额外的治疗选择对于帮助他们获得更好的结果至关重要,”希望之城血液肿瘤学家兼副教授Elizabeth Budde医学博士说。“像Lunsumio这样的新型免疫疗法令人兴奋,它提供了一种现成的、无需化疗和固定持续时间的治疗,具有提供持久缓解而无需持续治疗的巨大潜力。”
最常见的不良事件是细胞因子释放综合征(39%),通常为低级别(2级:14%),并在治疗结束时消退。其他常见(≥20%)AE是中性粒细胞减少、发热、低磷血症和头痛。
初始剂量是在没有强制住院的情况下给药的。
该研究结果于2021年12月在第63届美国血液学会年会暨博览会上首次公布。
目前,一项针对Lunsumio的强大开发计划正在进行中,包括两项III期研究:CELESTIMO,研究在二线加(2L+) FL中的Lunsumio加来那度胺,以及SUNMO,研究在2L+弥漫性大B细胞淋巴瘤(DLBCL)中的Lunsumio加Polivy (polatuzumab vedotin)。
这是罗氏在2022年第二次获得欧盟批准用于治疗淋巴瘤,此前Polivy批准将利妥昔单抗与环磷酰胺、阿霉素和强的松(R-CHP)联合用于之前未治疗的弥漫性大B细胞淋巴瘤。
滤泡性淋巴瘤(FL)是非霍奇金淋巴瘤(NHL)中最常见的惰性(生长缓慢)形式,约占NHL病例的五分之一。它被认为是不可治愈的,复发是常见的。据估计,全世界每年有超过100,000人被诊断患有FL,包括欧洲的超过28,000人。
参考来源:European Commission approves Roche’s first-in-class bispecific antibody Lunsumio for people with relapsed or refractory follicular lymphoma。
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。