百时美施贵宝(BMS)近日宣布,美国食品和药物管理局(FDA)已批准Onureg(阿扎胞苷300mg片剂,CC-486),该药是一种新的口服疗法,用于病情首次缓解的急性髓性白血病(AML)成人患者的继续治疗,具体为:用于接受强化诱导化疗实现首次完全缓解(CR)或血细胞计数未完全恢复的完全缓解(CRi)、且不能完成强化治愈性疗法(如造血干细胞移植)的AML成人患者的继续治疗。AML是成人中最常见的急性白血病之一。
Onureg是FDA批准的第一个也是唯一一个用于缓解期患者的AML继续疗法。Onureg通过优先审查程序获得批准。目前,该药用于相同适应症的营销授权申请(MAA)也正在接受欧洲药品管理局(EMA)的审查。用药方面,Onureg可一直持续到疾病进展或出现不可接受的毒性。由于药代动力学参数存在显著差异,Onureg不应代替静脉注射或皮下注射阿扎胞苷。
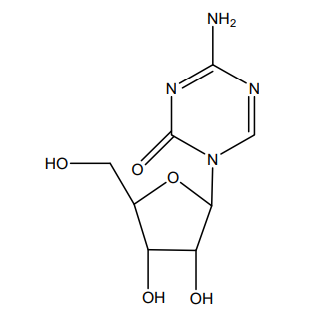
Onureg的活性药物成分为CC-486(阿扎胞苷),这是一种口服低甲基化剂,能结合到DNA和RNA中,允许由于长时间暴露而进行持续的表观遗传调控。目前,该药正被开发作为一款表观遗传学修饰剂,用于多种血液肿瘤的治疗。该药作用的主要机制被认为是DNA的低甲基化,以及对骨髓中异常造血细胞的直接细胞毒性。低甲基化可能恢复对分化和增殖至关重要的基因的正常功能。
阿扎胞苷化学结构式
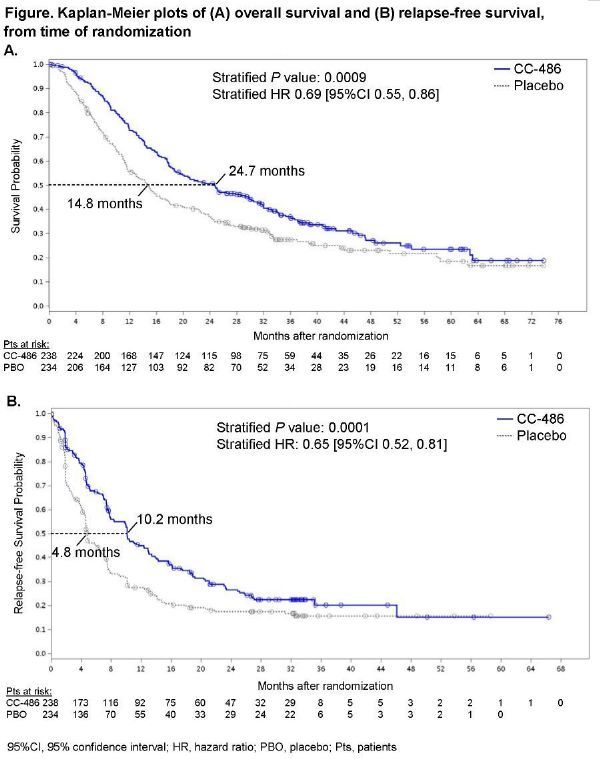
此次批准,基于关键III期QUAZAR AML-001研究的疗效和安全性结果。该研究在接受强化诱导化疗后病情缓解的新诊断的AML患者中开展,评估了Onureg作为一线维持治疗的疗效和安全性。结果显示,在一线维持治疗中,与安慰剂相比,Onureg将总生存期(OS,主要终点)显著提高了近10个月(中位 OS:24.7个月 vs 14.8个月,p=0.0009)、将无复发生存期(RFS,关键次要终点)显著提高了一倍多(中位PFS:10.2个月 vs 4.8个月,p=0.0001),结果具有统计学意义和临床意义的改善。
QUAZAR AML-001是一项国际性、随机、双盲、安慰剂对照III期研究,入组患者为年龄≥55岁、初发(de novo)或继发性(secondary)急性髓系白血病、有中等或高风险细胞遗传学、在强化诱导化疗后实现首次完全缓解(CR)或完全缓解伴不完全血象恢复(CRi)。根据研究者的选择,患者接受了强化诱导化疗,有或没有巩固化疗,并且在研究开始前被认为不是造血干细胞移植(HSCT)的候选者。
在强化诱导化疗后,81%的患者达到CR,19%的患者达到CRi。80%的患者在参与研究之前接受过至少一个周期的巩固治疗。472例患者随后以1:1的比例随机分为两组,分别接受:Onureg 300毫克治疗(n=238),安慰剂治疗(n=234),每天一次,每个周期治疗14天,每28天为一个周期。研究中,患者继续接受治疗,直到不可接受的毒性或疾病进展。
中位随访41.2个月,Onureg治疗组与安慰剂组相比在OS主要终点表现出显著改善。Onureg治疗组从随机化时间点开始的中位OS为24.7个月,而安慰剂组为14.8个月(p=0.0009;HR=0.69[95%CI:0.55,0.86])。关键次要终点RFS方面,Onureg治疗组中位RFS为10.2个月,安慰剂组为4.8个月(p=0.0001;HR=0.65[95%CI:0.52,0.81])。无论细胞遗传学风险类别、既往巩固情况或入组时CR/CRi状态如何,与安慰剂组相比,Onureg治疗组OS和RFS均有改善。与安慰剂组相比,Onureg治疗组健康相关生活质量(HRQoL)从基线水平保持不变。
Onureg的中位疗程为12个周期(1-80),安慰剂为6个周期(1-73)。Onureg和安慰剂所有级别中最常见的不良事件(AE)分别是恶心(65% vs 24%)、呕吐(60% vs 10%)和腹泻(50% vs 22%)。CC-486和安慰剂最常见的3-4级不良事件分别是中性粒细胞减少(41% vs 24%)、血小板减少(23% vs 22%)和贫血(14% vs 13%)。Onureg治疗组和安慰剂组分别有34%、25%的患者出现严重不良事件,主要是感染,分别发生在2个组17%、8%的患者中。Onureg治疗组和安慰剂组分别有13%、4%的患者因AE而停止治疗。
新诊断的AML成人患者,通过诱导化疗,通常能够获得完全缓解,但许多患者会复发,并经历不良的结果。病情处于缓解期的患者迫切需要一种能降低复发风险、延长总体生存期的治疗方案。Onureg的批准上市,将解决AML患者群体对新维持治疗方案的紧急医疗需求。
扩展阅读:
AML是最常见的急性白血病类型。AML开始于骨髓,但很快进入血液。与正常血细胞发育不同,在AML中,骨髓中异常白细胞的迅速积聚可能干扰正常血细胞的产生,导致健康白细胞、红细胞和血小板减少。AML是一种复杂多样的疾病,与多种基因突变有关,如果不加以治疗,病情通常会迅速恶化。
原文出处:U.S. Food and Drug Administration Approves Onureg® (azacitidine tablets), a New Oral Therapy, as Continued Treatment for Adults in First Remission with Acute Myeloid Leukemia
以上是关于(美国FDA批准Onureg:首个用于完全缓解患者的AML继续疗法)的最新资讯,如需了解Onureg更多资讯,可以直接联系我们药师客服。
以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。