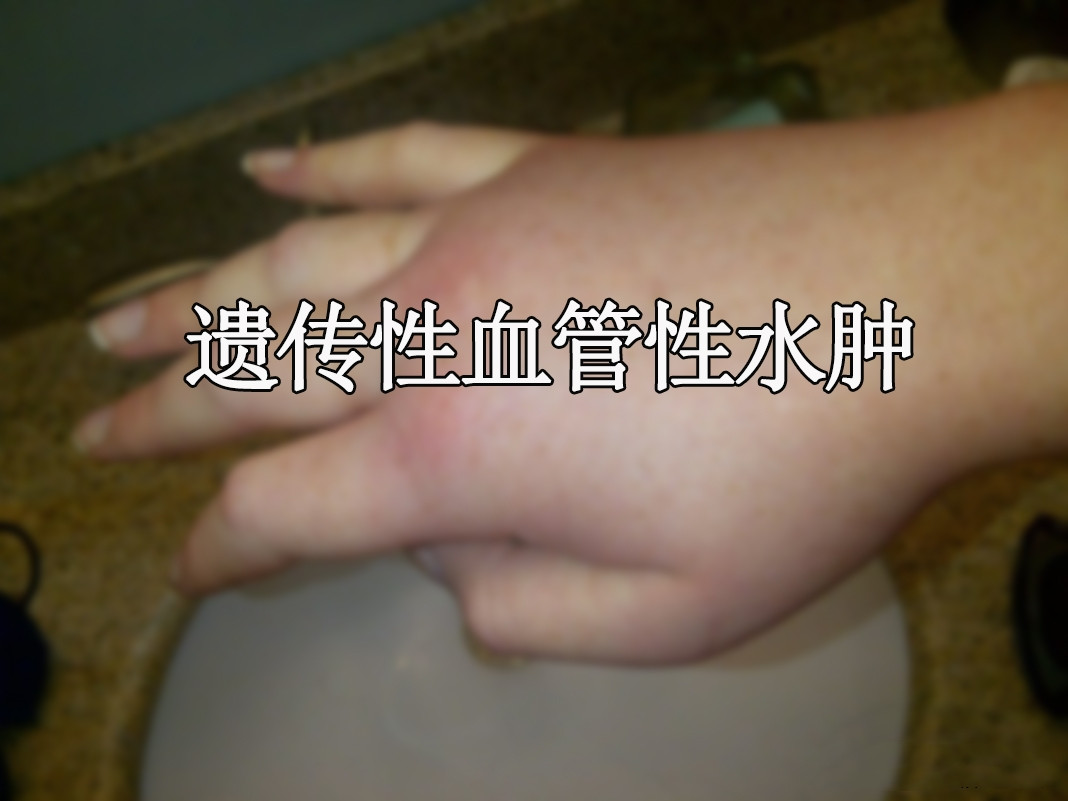
BioCryst生物技术公司于5月14日宣布,美国食品药品监督管理局(FDA)已同意优先审查Berotralstat(贝罗司他)的新药申请,用于治疗2至11岁患有遗传性血管性水肿(HAE)的儿科患者的预防性治疗。《处方药使用者付费法案》已为该申请指定了2025年9月12日的目标日期。
如果获得批准,Berotralstat将成为首个针对12岁以下儿童的口服预防性遗传性血管性水肿疗法。
遗传性血管性水肿(HAE)是一种罕见的遗传性疾病,患者体内缺乏或无法有效抑制缓激肽的生成,导致组织水肿。Berotralstat(商品名Orladeyo)是一种血浆激肽释放酶抑制剂,通过抑制缓激肽生成,从而预防HAE的急性发作。Orladeyo最初于2020年12月获FDA批准,用于预防12岁及以上患者的HAE发作。目前,该药物已在30多个国家上市。
这种疗法目前是以胶囊的形式提供的;BioCryst表示,还向欧洲药品管理局提交了Orladeyo口服颗粒剂用于治疗2至11岁HAE患者的产品线扩展申请。该公司计划在全球其他地区(包括日本和加拿大)提交更多监管申请。
此次新药申请的提交基于3期APex-P试验(ClinicalTrials.gov 标识符:NCT05453968)的数据,该试验评估了Berotralstat在2岁至12岁以下、体重至少12公斤患者中的预防性治疗效果。
在试验中,29名参与者接受了12周的标准治疗(SOC)治疗,之后开始每日根据体重服用Berotralstat剂量。在SOC 期间,HAE发作率中位数为0.96(范围:0-5.0)。从第1个月到第12个月,每月中位HAE发作率为0(范围:第1个月:0-4.0;第12个月:0-1.7)。
鼻咽炎、上呼吸道感染和头痛是最常见的报告不良反应。
BioCryst首席研发官Helen Thackray博士说:“正如APeX-P研究结果中详细描述的,我们观察到参与者在很小的年龄就经历了严重的HAE发作,出现HAE症状的中位年龄为2岁,这表明在更小的年龄就有更大的疾病负担,这一点迄今为止还没有得到认识。”“如果获得批准,我们相信这种口服Orladeyo颗粒制剂可以帮助HAE儿童和他们的家人更好地控制他们的病情,避免急性发作的急诊或住院的痛苦经历。”
参考来源:
BioCryst announces FDA acceptance of NDA for Orladeyo® (berotralstat) oral granules in patients with hereditary angioedema aged 2 to 11 years. News release. BioCryst. May 14, 2025.
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。