Y-mAbs是一家处于商业阶段的生物制药公司,致力于开发和商业化新型、基于抗体的癌症治疗产品。近日,该公司宣布,美国食品和药物管理局(FDA)已批准Danyelza(naxitamab-gqgk)40mg/10ml,联合粒细胞-巨噬细胞集落刺激因子(GM-CSF),用于治疗复发/难治性高危神经母细胞瘤患者,具体为:年龄≥1岁、对先前疗法显示出部分缓解、轻微反应或疾病稳定、骨骼或骨髓中存在复发或难治性高危神经母细胞瘤的儿科和成人患者。
该适应症根据总缓解率和缓解持续时间或的加速批准,对该适应症的持续批准可能取决于验证性试验中临床益处的验证和描述。此前,FDA已授予Danyelza优先审查、孤儿药资格(ODD)、突破性药物资格(BTD)、罕见儿科疾病资格(RPDD)。
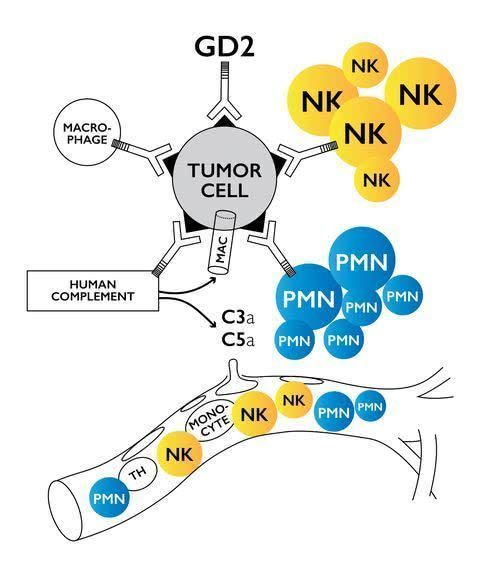 naxitamab作用机制(图片来源:Y-mAbs公司网站)
naxitamab作用机制(图片来源:Y-mAbs公司网站)
FDA批准Danyelza,基于2项关键性II期研究(201和12-230)的安全性和有效性数据。去年10月,Y-mAbs公司在法国里昂举行的国际儿童肿瘤学会(SIOP)年会上公布了Danyelza联合GM-CSF治疗复发/难治性高危神经母细胞瘤儿童患者12-230研究(NCT01757626)的数据。
该研究的一个亚组包括28例原发性难治性高危神经母细胞瘤儿童患者,这些患者对强化诱导治疗无效,并且超过一半的患者也对二线化疗难治。研究中,这些患者接受了Danyelza与GM-CSF联合治疗。结果显示,客观缓解率(ORR)为78%、有50%的患者无进展生存期(PFS)达到24个月。
该研究的另一个亚组包括35例对挽救性疗法(salvage therapy)有抵抗力的复发性神经母细胞瘤儿童患者,其中30例可评估疗效。有三分之一的患者在入组研究前疾病复发两次或两次以上,有89%的患者曾接受过抗GD2药物治疗。在这组患者中,Danyelza与GM-CSF联合治疗的总缓解率(ORR)为37%,表明该治疗方案在这类难治性患者中具有显著临床益处。
神经母细胞瘤是一种极具侵袭性的肿瘤,是婴幼儿最常见的肿瘤之一,尽管近年来强化多模式治疗已提高了生存率,但幸存者有很高的复发风险。
原文出处:FDA approves Y-mAbs’DANYELZA® (naxitamab-gqgk) for the Treatment of Neuroblastoma
以上是关于(新型GD2靶向抗体Danyelza获美国FDA优先审查,联合GM-CSF用于神经母细胞瘤,总缓解率高达78%)的最新资讯,如需了解Danyelza更多资讯,可以直接联系我们药师客服。
以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。




