近日,Alnylam公司公布了评估lumasiran治疗PH1患者的ILLUMINATE-B儿科3期研究的阳性结果。这是一种RNAi药物在临床试验中获得阳性结果的第7项3期研究,也是评估RNAi药物治疗6岁以下儿童(包括婴儿)疗效和安全性的第一个研究。
lumasiran是继Onpattro(patisiran,静脉制剂)、Givlaari(givosiran,皮下制剂)的全球第三款RNAi疗法。目前,lumasiran正在接受美国FDA的优先审查、欧盟EMA的加速批准,该药用于治疗原发性高草酸尿症1型(PH1)。FDA已指定目标行动日期为2020年12月3日。
ILLUMINATE-B(NCT03905694)是一项单臂、开放标签、多中心3期试验,在全球5个国家9个研究中心招募了18例年龄在6岁以下(范围:3-72个月)的PH1儿科患者。研究中,lumasiran按照基于体重的给药方案进行给药。
结果显示,在第6个月时,与基线相比,lumasiran治疗使尿液中草酸:肌酐比值显示出临床意义的降低。尿草酸相对于基线的减少,在所有3种体重类别(小于10公斤;10公斤到20公斤,以及20公斤或更高)中是一致的。lumasiran在次要终点也显示出阳性结果,包括尿和血浆草酸的额外测量指标。研究中,没有出现与研究药物相关的严重不良事件,并且lumasiran的总体安全性和耐受性与LIMITENT-A研究中观察到的一致。完整的ILLUMINATE-B研究结果将于2020年10月22日在ASN虚拟大会上公布。
PH1(图片来源于网络)
PH1是一种超级罕见、进行性、毁灭性疾病,影响肾脏和其他重要器官,该病由过量的草酸生成引起,尿草酸水平升高与进展到终末期肾病和其他全身并发症相关。PH1可导致肾衰竭,具有显著的发病率和死亡率,尚无批准的药物。目前的治疗方法,并不能防止草酸盐过量产生,只是减轻对肾脏的损害,延缓ESKD的进展。PH1该病影响婴儿、儿童和成人,患者面临着反复和痛苦的结石事件,以及肾功能进行性和不可预测的下降,最终导致终末期肾病,需要进行强化透析,作为肝/肾双重移植的桥梁。PH1通常在儿童期发病,需要立即进行有效的干预,晚期患者除了透析之外别无选择,而肝移植是目前唯一解决疾病根源的治疗方法。
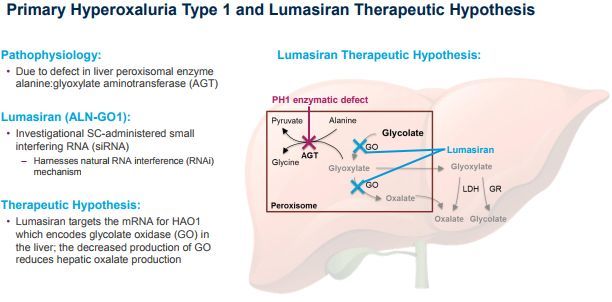
lumasiran是一种靶向羟基酸氧化酶1(HAO1)的皮下注射RNAi药物,开发用于原发性高草酸尿症1型(PH1)的治疗。HAO1编码乙醇酸氧化酶(GO)。因此,通过沉默HAO1和消耗GO酶,lumasiran可抑制肝脏中草酸(直接参与PH1病理生理学的代谢物)的产生并使其正常化,从而潜在地阻止PH1疾病的进展。
lumasiran是第一种显示出显著减少尿草酸排泄量的疗法。来自III期ILLUMINATE-A研究(NCT03681184)的结果证实,lumasiran显著减少了肝脏中草酸的生成,有潜力解决PH1的内在病理生理学问题,并有潜力对PH1患者产生有意义的临床影响。在美国,lumasiran已被FDA授予治疗PH1的儿科罕见病资格、孤儿药资格(ODD)、突破性药物资格(BTD)。在欧盟,lumasiran已被授予孤儿药资格(ODD)、优先药物资格(PRIME)。这些资格认定,共同强调了lumasiran解决PH1潜在病理生理学问题的潜力。
原文出处:Alnylam Reports Positive ToplineResults from ILLUMINATE-B Phase 3 Study of Lumasiran for the Treatment ofPrimary Hyperoxaluria Type 1 in Children Under the Age of Six
以上是关于(第三款RNAi药物lumasiran治疗原发性高草尿酸症1型儿科3期研究获成功!)的最新资讯,如需了解lumasiran更多资讯,可以直接联系我们药师客服。
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。