2022年9月9日,百时美施贵宝公司宣布,美国食品药品监督管理局(FDA)批准了Sotyktu(Deucravacitinib),用于治疗适合全身治疗或光疗的中度至重度斑块型银屑病成人。不建议将Sotyktu与其他强效免疫抑制剂联合使用。
Sotyktu是一种首创的、口服、选择性、变构酪氨酸激酶2(TYK2)抑制剂,是全球唯一获批的TYK2抑制剂,也是近10年来中重度斑块型银屑病口服治疗的首个创新。Sotyktu具有一种新的作用机制,将为中重度斑块型银屑病患者群体带来一种受欢迎的新一线口服治疗方案。
【生产企业】百时美施贵宝
【规格】6mg,片剂
【商标】Sotyktu
【通用名】Deucravacitinib
【贮藏】于20°C到25°C储存,允许的偏移范围为15℃至30℃。
【Sotyktu(Deucravacitinib)适应症】
Sotyktu适用于接受全身治疗或光疗的成人中重度斑块型银屑病的治疗。
使用限制:Sotyktu不建议与其他有效的免疫抑制剂联合使用。
【Sotyktu(Deucravacitinib)推荐剂量和给药方法】
一、治疗开始前的推荐评估和免疫接种
在开始使用Sotyktu治疗之前,评估患者的活动性和潜伏性结核(TB)感染。如果呈阳性,在使用Sotyktu之前开始治疗结核病。
二、推荐剂量
Sotyktu的推荐剂量为6 mg,每天口服一次,随餐或不随餐服用。不要压碎、切割或咀嚼药片。
三、肝功能损害患者的推荐剂量
严重肝功能损害(Child-Pugh C)的患者不建议使用Sotyktu。轻度至中度肝功能损害的患者无需调整剂量。
四、用药过量
没有关于人类过量使用Sotyktu的经验。通过血液透析消除Deucravacitinib的程度较小(每次透析治疗剂量的5.4%),因此用于治疗Sotyktu用药过量的血液透析是有限的。
【Sotyktu(Deucravacitinib)的警告和注意事项】
一、超敏反应
接受Sotyktu治疗的受试者曾报告过血管性水肿等过敏反应。如果出现临床上显著的过敏反应,应采取适当的治疗并停用Sotyktu。
二、感染
Sotyktu可能会增加感染的风险。据报道,接受Sotyktu治疗的银屑病患者出现了严重感染。Sotyktu报告的最常见严重感染包括肺炎和新冠肺炎。患有活动性或严重感染的患者应避免使用Sotyktu。在对以下患者开始Sotyktu治疗前,请考虑治疗的风险和益处:慢性或复发性感染患者;接触过结核病患者;有严重或机会性感染史患者,有可能导致感染的潜在疾病。
在使用Sotyktu治疗期间和之后,密切监测患者的感染体征和症状的发展。在Sotyktu治疗期间出现新感染的患者应接受及时和完整的诊断检测;应开始适当的抗菌治疗;应该密切监视病人。如果患者出现严重感染,中断Sotyktu。在感染消退或得到充分治疗之前,不要恢复使用Sotyktu。
病毒再激活:在Sotyktu的临床试验中,报告了疱疹病毒再激活(如带状疱疹、单纯疱疹)。在为期16周的安慰剂对照期中,有17名接受Sotyktu治疗的受试者(6.8/100患者年)和1名接受安慰剂治疗的受试者(0.8/100患者年)报告了单纯疱疹感染。一名接受Sotyktu治疗的免疫活性受试者报告了多发性皮肤带状疱疹。在PSO-1、PSO-2和完成对照试验的受试者可以参加的开放标签扩展试验期间,大多数在接受Sotyktu时报告带状疱疹事件的受试者年龄在50岁以下。Sotyktu对慢性病毒性肝炎再激活的影响尚不清楚。乙型或丙型肝炎、慢性乙型肝炎或未经治疗的丙型肝炎筛查阳性的受试者被排除在临床试验之外。在开始治疗前和使用Sotyktu治疗期间,根据临床指南,考虑对病毒性肝炎进行筛查和再激活监测。如果出现再激活的迹象,请咨询肝炎专家。不建议活动性乙型肝炎或丙型肝炎患者使用Sotyktu。
三、肺结核
在临床试验中,4名接受Sotyktu治疗并接受适当结核病预防的潜伏性结核病受试者中,无受试者出现活动性结核病(平均随访34周)。一名未患潜伏性结核病的受试者在接受54周的Sotyktu治疗后发展为活动性结核病。在开始Sotyktu治疗前,评估患者的潜伏和活动性结核感染。不要对活动性肺结核患者使用Sotyktu。在服用Sotyktu前开始治疗潜伏性结核。对于既往有潜伏或活动期结核病史且不能确定充分疗程的患者,考虑在开始Sotyktu治疗前进行抗结核治疗。在治疗期间,监测接受Sotyktu治疗的患者的活动性结核病体征和症状。
四、恶性肿瘤,包括淋巴瘤
在使用Sotyktu的临床试验中观察到恶性肿瘤,包括淋巴瘤。在开始或继续使用Sotyktu治疗前,考虑患者个体的益处和风险,特别是患有已知恶性肿瘤(除了成功治疗的非黑色素瘤皮肤癌)的患者和在使用Sotyktu治疗时发展为恶性肿瘤的患者。
五、横纹肌溶解症和CPK升高
在接受Sotyktu治疗的受试者中报告了横纹肌溶解症病例,导致Sotyktu给药中断或停止。与安慰剂治疗相比,Sotyktu治疗与无症状肌酸磷酸激酶(CPK)升高和横纹肌溶解的发生率增加有关。如果出现CPK水平明显升高或诊断或怀疑有肌病,应停止使用Sotyktu。指导患者立即报告任何无法解释的肌肉疼痛、压痛或无力,尤其是如果伴有不适或发热。
六、实验室异常
甘油三酯升高:使用Sotyktu治疗与甘油三酯水平升高相关。这一参数升高对心血管发病率和死亡率的影响尚未确定。在患者接受Sotyktu治疗期间,根据高脂血症临床指南定期评估血清甘油三酯。根据高脂血症管理的临床指南管理患者。
肝酶升高:与安慰剂治疗相比,Sotyktu治疗与肝酶升高的发生率增加相关。在接受Sotyktu治疗的受试者中,有5例转氨酶升高≥ 3倍ULN。根据常规患者管理,在基线时评估肝酶,之后评估已知或疑似肝病患者的肝酶。如果出现与治疗相关的肝酶升高,并且怀疑是药物性肝损伤,则中断Sotyktu,直到排除肝损伤的诊断。
七、免疫接种
在开始使用Sotyktu进行治疗之前,考虑根据当前的免疫指南完成所有适龄免疫接种,包括预防性带状疱疹疫苗接种。避免在接受Sotyktu治疗的患者中使用活疫苗。尚未评估对活疫苗或非活疫苗的反应。
八、与JAK抑制相关的潜在风险
尚不清楚TYK2抑制是否与Janus激酶(JAK)抑制的观察到的或潜在的不良反应相关。在一项关于JAK抑制剂治疗类风湿性关节炎(RA)的大型随机上市后安全性试验中,观察到接受JAK抑制剂治疗的患者与接受TNF阻滞剂治疗的患者相比,其全因死亡率更高,包括心血管猝死、主要心血管不良事件、总体血栓形成、深静脉血栓形成、肺栓塞和恶性肿瘤(不包括非黑色素瘤皮肤癌)。Sotyktu未被批准用于RA。
【Sotyktu(Deucravacitinib)禁忌症】
对Deucravacitinib或Sotyktu中的任何辅料有过敏反应史的患者禁用Sotyktu。
【Sotyktu(Deucravacitinib)药物相互作用】
无相关信息。
【Sotyktu(Deucravacitinib)不良反应】
1.Sotyktu可能会导致严重的副作用,包括:荨麻疹、呼吸困难、面部、嘴唇、舌头或喉咙肿胀、疲劳、发烧、深色尿液、肌肉疼痛或触痛以及肌肉无力。如果您有上述任何症状,请立即就医。
2.Sotyktu最常见的副作用包括:痤疮、感冒症状、喉咙痛、鼻窦感染、唇疱疹、口腔溃疡和毛孔发炎。
【Sotyktu(Deucravacitinib)在特殊人群中使用】
1、妊娠
关于妊娠期使用Sotyktu的病例报告中的可用数据不足以评估重大出生缺陷、流产或不良母亲或胎儿结局的药物相关风险。在动物生殖研究中,在器官形成期间,大鼠和兔子口服Deucravacitinib,剂量至少为人类最大推荐剂量(MRHD)的91倍,即每天一次6 mg,未观察到对胚胎-胎儿发育的影响。
2、哺乳期
没有关于母乳中存在Deucravacitinib、对母乳喂养婴儿的影响或对泌乳量的影响的数据。Deucravacitinib存在于大鼠乳汁中。当一种药物存在于动物乳汁中时,该药物也可能存在于人乳中。应考虑母乳喂养的发育和健康益处,以及母亲对Sotyktu的临床需求,以及Sotyktu或潜在母体状况对母乳喂养婴儿的任何潜在不利影响。
3、老年人用药
在接受Sotyktu治疗的1,519名斑块型银屑病受试者中,152名(10%)受试者为65岁或以上,21名(1.4%)受试者为75岁或以上。在第0-16周期间,与较年轻的成年人相比,接受Sotyktu且未转换治疗组的受试者(80名≥ 65岁的受试者,包括12名≥ 75岁的受试者)的总体严重不良反应(包括严重感染)和因不良反应而停药的发生率较高。未观察到65岁患者与老年和年轻成年患者之间Sotyktu有效性的总体差异。
4、儿科用药
Sotyktu在儿科患者中的安全性和有效性尚未确定。
5、肾功能损害
不建议轻度、中度或重度肾功能损害患者或接受透析治疗的终末期肾病患者(ESRD)调整Sotyktu的剂量。
6、肝功能损害轻度(Child-Pugh A级)或中度(Child-Pugh B级)
肝功能损害患者不建议调整Sotyktu的剂量。不建议严重肝功能损害(Child-Pugh C级)的患者使用Sotyktu。
【Sotyktu(Deucravacitinib)一般描述】
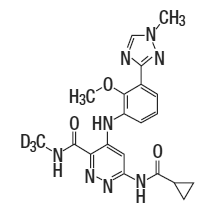
Deucravacitinib是一种酪氨酸激酶2(TYK2)抑制剂,分子式为C20H19D3N8O3,游离碱的分子量为425.47。Deucravacitinib的结构式:
Deucravacitinib结构式
Deucravacitinib为白色至黄色粉末,的溶解度是pH依赖性的,溶解度随着pH值的增加而降低。
Sotyktu (Deucravacitinib)片剂的口服剂量为6 mg。每片含有作为活性成分的deucravacitinib和下列非活性成分:无水乳糖、交联羧甲基纤维素钠、羟丙甲纤维素乙酸琥珀酸酯、硬脂酸镁、微晶纤维素和二氧化硅。此外,Opadry II粉红色薄膜包衣含有以下非活性成分:氧化铁红、氧化铁黄、聚乙二醇、聚乙烯醇、滑石和二氧化钛。
【Sotyktu(Deucravacitinib)作用机制】
Deucravacitinib是酪氨酸激酶2 (TYK2)的抑制剂。TYK2是Janus激酶(JAK)家族的成员。Deucravacitinib与TYK2的调节域结合,稳定该酶的调节域和催化域之间的抑制性相互作用。这导致变构抑制受体介导的TYK2激活及其下游信号转导和转录激活因子(STATs)的激活,如基于细胞的试验所示。JAK激酶,包括TYK2,在JAK-STAT途径中作为同源或异源二聚体发挥作用。
如基于细胞的试验所示,TYK2与JAK1配对以介导多种细胞因子途径,也与JAK2配对以传递信号。目前尚不清楚在治疗患有中度至重度斑块型银屑病的成人中,将抑制TYK2酶与疗效联系起来的确切机制。
【Sotyktu(Deucravacitinib)患者资讯资料】
1、过敏反应:建议患者停止使用Sotyktu,如果出现任何严重过敏反应症状,应立即就医。
2、感染:告知患者,Sotyktu可能会降低其免疫系统抵抗感染的能力,如果患者出现任何感染迹象或症状,应立即联系医生。告知患者,使用Sotyktu可能会发生疱疹感染,包括严重感染。
3、恶性肿瘤(包括淋巴瘤):告知患者Sotyktu可能会增加他们患恶性肿瘤(包括淋巴瘤)的风险。指导患者告知其医生他们是否患有任何类型的癌症。
4、横纹肌溶解症:告知患者Sotyktu可能会增加他们患横纹肌溶解症的风险。如果患者出现不明原因的肌肉疼痛、压痛或虚弱,特别是伴有不适或发烧,请指导患者立即通知医生。
5、实验室异常:告知患者Sotyktu可能会影响某些实验室检查,并且在Sotyktu治疗前和治疗期间可能需要进行血液检查。
6、免疫接种:建议患者在Sotyktu治疗期间不建议接种活疫苗。与免疫系统相互作用的药物可能会增加接种活疫苗后感染的风险。指导患者告知医生,他们在可能的疫苗接种之前正在服用Sotyktu。
信息来源:
[1]https://www.rxlist.com/sotyktu-drug.htm
[2]https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/214958s000lbl.pdf
[3] https://ndclist.com/ndc/0003-0895
注:药品如有新包装,以新包装为准。以上资讯为高等医药院校的学生志愿者翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。