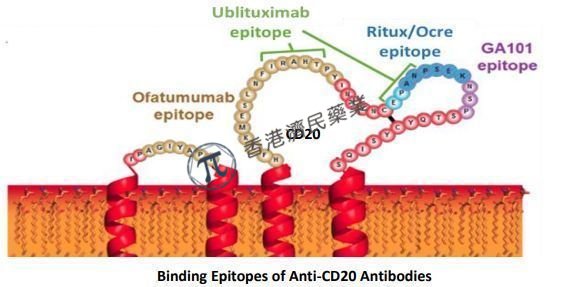
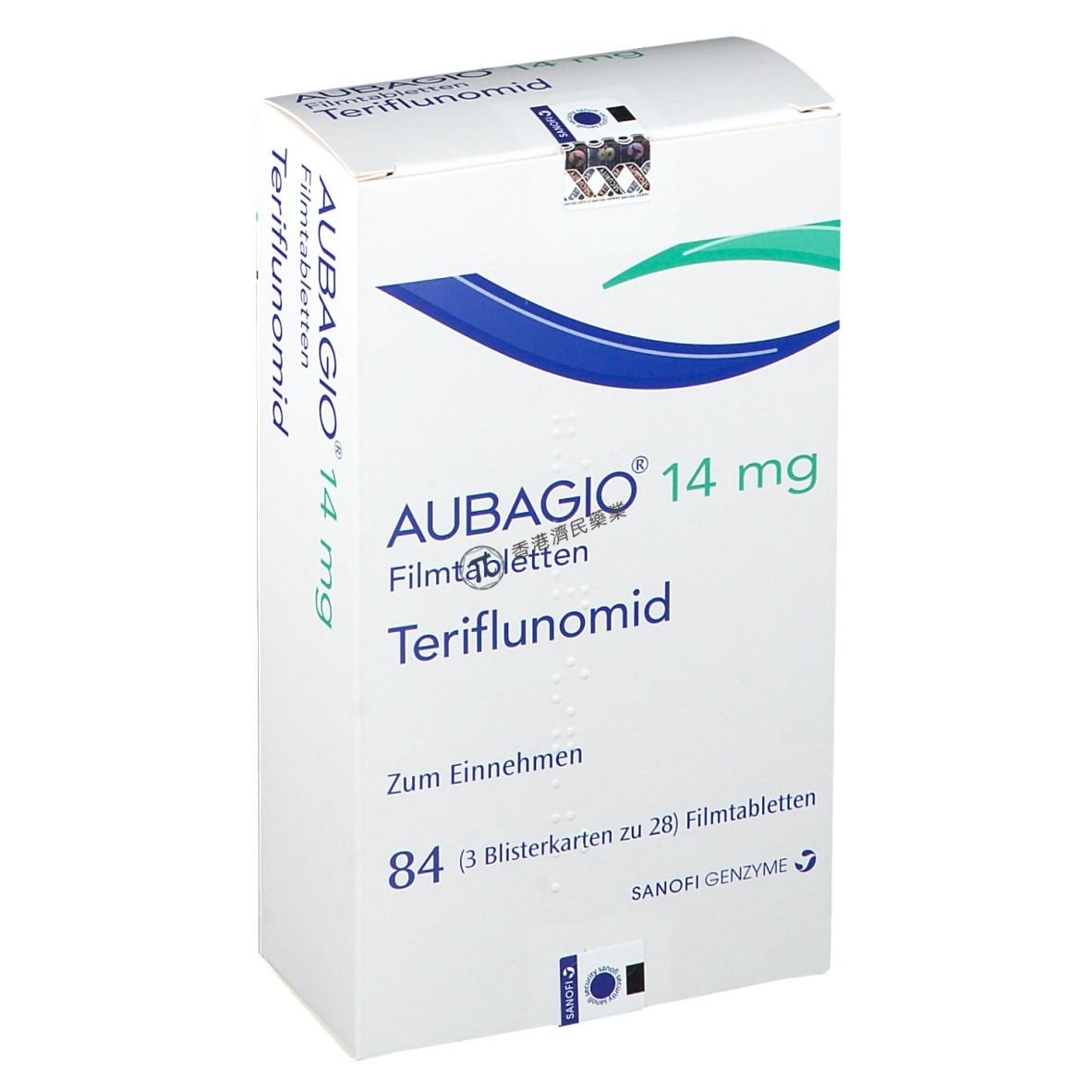
近日,TG Therapeutics公司公布了ublituximab与目前广泛使用的一线口服标准护理药物Aubagio 2项全球性阳性药物对照3期临床试验(ULTIMATE I & II)的数据。
这些试验在复发型多发性硬化(RMS)患者中开展,将ublituximab与目前广泛使用的一线口服标准护理药物Aubagio(teriflunomide,特立氟胺)进行了比较。(结果详见:ULTIMATE I & II EAN2021 Steinman FNAL PDF)。
 多发性硬化
多发性硬化
ULTIMATE I & II研究(NCT03277261;NCT03277248)调查了ublituximab 450mg静脉输注(第1天150mg[静脉输注4小时以上],第15天450mg[静脉输注1小时以上],之后每6个月给药一次450mg[静脉输注1小时以上])、Aubagio(14mg口服片,每日一次)治疗RMS患者的疗效和安全性。2项研究的结果如下:
1.主要终点-年化复发率(ARR)结果:在ULTIMATE I研究中,ublituximab治疗组的ARR为0.076,而Aubagio治疗组的ARR为0.188,相对降低了约60%(p<0.0001)。在ULTIMATE II研究中,ublituximab治疗组的ARR为0.091,而Aubagio治疗组的ARR为0.178,相对降低了约50%(p=0.0022)。
2.MRI结果:在ULTIMATE I和ULTIMATE II研究中,ublituximab治疗组与Aubagio治疗组相比,MRI扫描的T1钆增强(Gd+T1)病灶总数分别减少了97%和96%(p<0.0001)、新的或扩大的T2病灶数量分别接受了92%和90%(p<0.0001)。
3.无疾病活动证据(NEDA)结果:在ULTIMATE I研究中,ublituximab治疗组有44.6%的患者达到NEDA,比Aubagio治疗组改善198%(p<0.0001)。在ULTIMATE II研究中,ublituximab治疗组有43%的患者达到NEDA,比Aubagio治疗组改善了277%(p<0.0001)。
4.预先指定的汇总残疾结果:(1)所有治疗组的残疾进展率都很低。ublituximab治疗组有5.2%(Aubagio治疗组有5.9%)的患者出现12周确认残疾进展(CDP)、有3.3%(Aubagio治疗组有4.8%)的患者出现24周CDP。2者在统计学上均没有显著差异。(2)ublituximab治疗组实现12周确认残疾改善(CDI)和24周CDI的患者比例增加,与Aubagio相比12周CDI几率增加了116%(12% v 6%;p=0.0003)、24周CDI几率增加103%(9.6% v 5.1%;p=0.0026)。
5.安全性:ublituximab总体耐受性良好,无意外安全信号。总体而言,在2项研究的汇总分析中,ublituximab组发生不良事件的患者比例与Aubagio组相似(每个治疗组约88%);与ublituximab相关的最常见不良事件是输液相关反应(ublituximab组有47.7%的患者出现至少一次输液相关反应,而Aubagio组为12.2%)。
这2项研究是在与美国FDA达成的特别方案评估(SPA)协议下开展的。2项研究均达到了主要终点:结果显示在治疗96周期间,ublituximab与Aubagio相比将年化复发率(ARR)在统计学上显著降低(每个试验中p<0.005)。
2项研究中,ublituximab治疗组的ARR均<0.10,与Aubagio组相比ARR相对降低率分别约为60%和50%。2项研究也达到了磁共振成像(MRI)关键次要终点。这些数据,将用于支持ublituximab治疗RMS的生物制品许可申请(BLA),该BLA计划2021年第三季度提交。
原文出处:TG Therapeutics Announces Presentation of Data from the ULTIMATE I & II Phase 3 Trials of Ublituximab in Multiple Sclerosis at 7th Congress of the European Academy of Neurology
注:以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。