德琪医药合作伙伴Karyopharm Therapeutics近日宣布,美国食品和药物管理局(FDA)已批准Xpovio(selinexor)第二个肿瘤适应症,用于治疗接受过至少2种系统疗法的复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)成人患者,包括滤泡性淋巴瘤(FL)引起的DLCBL。
该适应症基于缓解率数据通过FDA的加速审批程序获得批准。针对该适应症的持续批准可能取决于验证性试验中对临床益处的验证和描述。Karyopharm公司还计划在2021年向欧洲药品管理局(EMA)提交Xpovio治疗复发或难治性DLBCL的营销授权申请(MAA)。
此次DBLCL适应症,基于多中心、单臂IIb期SADAL研究的阳性结果。该研究在134例复发或难治性DLBCL患者中开展,这些患者先前接受的系统疗法中位数为2种(范围:1-5种)。研究中,患者接受固定60mg剂量Xpovio治疗、每日口服2次、4周一个周期。有生发中心B细胞(GCB)或非GCB亚型的DLBCL患者也被纳入了研究。
数据显示,Xpovio治疗总缓解率(ORR)为29%、完全缓解率(CR)为13%、部分缓解率(PR)为16%。在病情缓解的患者中,中位缓解持续时间(DOR)超过9个月,56%的患者缓解持续时间≥3个月、38%的患者≥6个月、15%的患者≥12个月。这些数据突出了Xpovio作为一种新的、首创的口服疗法,在先前接受过至少2种多药方案、不适合干细胞移植、治疗方案极其有限的复发或难治性DLBCL患者群体中的潜力。
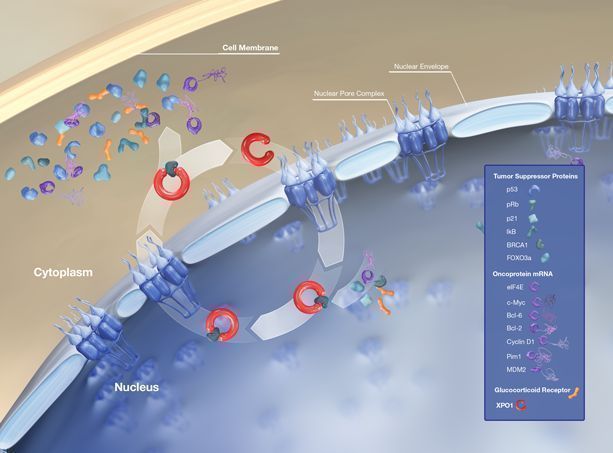
Xpovio是一款唯一一个获FDA批准的首创(first-in-class)、选择性核输出抑制剂(SINE)。通过结合并抑制核输出蛋白XPO1(又名CRM1)发挥作用,导致肿瘤抑制蛋白在细胞核内积累,这将重新启动并放大它们的肿瘤抑制功能,导致癌细胞选择性凋亡,同时不会对正常细胞造成显著影响,2018年8月,德琪医药与Karyopharm Therapeutics达成战略合作,共同开发4款口服创新药物,包括3款SINE XPO1拮抗剂Xpovio(selinexor)、eltanexor、verdinexor和一款PAK4和NAMPT双靶点抑制剂KPT-9274。2019年1月,ATG-010(Xpovio)治疗难治复发多发性骨髓瘤在中国获批临床批件,该药也是中国市场开发用于多发性骨髓瘤的首个选择性核输出抑制剂(SINE)。此外,Xpovio也是自2015年以来首次针对骨髓瘤新靶点(XPO1)的批准药物。
2019年7月,Xpovio获得美国FDA加速批准,联合地塞米松,用于既往接受过至少4种疗法且对至少2种蛋白酶体抑制剂(PI)、至少2种免疫抑制剂(IMiD)、一种抗CD38单克隆抗体难治的复发难治多发性骨髓瘤(RRMM)患者。
今年5月,Karyopharm公司向美国FDA提交了Xpovio的另一份补充新药申请(sNDA),寻求批准Xpovio作为一种新的疗法,用于治疗先前至少接受过一种疗法的多发性骨髓瘤(MM)患者。
此次sNDA,基于III期BOSTON研究的阳性顶线结果。该研究在既往接受过1-3种疗法的复发或难治性MM患者中开展,评估了每周一次Xpovio与每周一次Velcade(bortezomib,硼替佐米)和低剂量地塞米松联合用药方案(SVd)、每周2次Velcade与低剂量地塞米松联合用药方案(Vd)的疗效和安全性。Vd是临床治疗MM的一种标准疗法。
结果显示,研究达到了主要终点:与Vd治疗组相比,SVd治疗组疾病无进展生存期(PFS)增加4.47个月、增加幅度达47%(中位PFS:13.93个月 vs 9.46个月),并且疾病进展或死亡风险显著降低了30%(HR=0.70,p=0.0066)。此前,与Vd治疗组相比,SVd治疗组总缓解率(ORR)也显著提高。该研究中,SVd治疗组没有观察到新的安全信号,2组之间的死亡也没有失衡。
如果获得批准,Xpovio将为复发或难治性MM患者的治疗模式提供一个重要的补充。目前,Karyopharm正在多个中后期临床研究中评估selinexor治疗一系列血液系统恶性肿瘤和实体瘤的潜力,包括多发性骨髓瘤(MM)、弥漫性大B细胞淋巴瘤(DLBCL)、脂肪肉瘤(SEAL研究)、子宫内膜癌、复发性胶质母细胞瘤。
扩展阅读:
Xpovio是目前被批准用于治疗复发或难治性DLBCL的唯一一种单药口服疗法。之前,FDA已授予Xpovio治疗该适应症的孤儿药资格和快速通道资格。此外,Xpovio是第一个也是唯一一个获FDA批准可同时用于骨髓瘤和DLBCL的药物。
原文出处:Karyopharm Announces FDA approval of XPOVIO® (selinexor) for the Treatment of Patients with Relapsed or Refractory Diffuse Large B-cell Lymphoma (DLBCL)
以上资讯来源于网络,由香港济民药业整理编辑(如有错漏,请帮忙指正),只为提供全球最新上市药品的资讯,帮助中国患者了解国际新药动态,仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。