赛诺菲(Sanofi)与Sobi共同开发的Altuviiio(Efanesoctocog alfa)于2023年2月23日获美国食品药品监督管理局(FDA)批准上市,治疗A型血友病成人和儿童的常规预防和按需治疗,以控制出血事件,以及围手术期管理(手术)。预计将于2023年下半年向欧盟提交监管文件。
此次获批,Altuviiio成为首个也是唯一一个A型血友病治疗药物。其新药申请由FDA根据优先审评进行评估,此前它于2022年5月获得突破性疗法认定,2021年2月获得快速通道认定,2017年8月获得孤儿药认定。
FDA批准Altuviiio是基于关键 XTEND-1 Ⅲ期研究的数据,XTEND-1是一项开放标签、非随机的介入试验,目的为检视在那些曾经接受过凝血因子VIII疗法、12岁或以上的严重血友病A患者中(n=159),以一周一次剂量的Altuviiio治疗时的疗效与安全性。试验结果显示,每周一次Altuviiio预防性治疗,显著降低严重血友病A患者中的年出血率。与此前接受的凝血因子VIII预防性治疗相比,Altuviiio在预防出血方面亦表现出优效性。至于安全性,此药物也展现良好的耐受性,没有在患者体内观察到凝血因子VIII抑制剂的产生。最常见的治疗伴发不良反应(出现在>5%总病患中)包含头痛、关节疼痛(arthralgia)、跌倒与背痛。
【生产企业】赛诺菲(Sanofi)与Sobi
【规格】仅供静脉注射使用。
1.每个Altuviiio药瓶标签以国际单位(IU或unit)表示因子VIII活性。
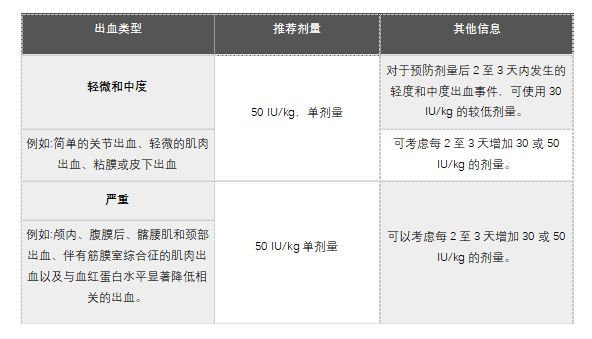
2.常规预防:50IU/千克,每周一次。
3.对于按需治疗、出血事件控制和围手术期管理:50 IU/kg。因子VIII的估计增量(IU/dL或正常的百分比)= 50 IU/kg x 2(IU/dL/IU/kg)
4.要达到特定的目标因子VIII活性水平,请使用以下公式:剂量(IU) =体重(kg)*所需的因子VIII增加量(IU/dL或正常百分比)*0.5(IU/kg/IU/dL)。
【商标】Altuviiio
【通用名】Epanesectcog alfa
【贮藏】
1、复溶前
1)将Altuviiio储存在原包装中,以保护Altuviiio免受光照。
2)将粉末状Altuviiio储存在2℃至8℃的环境中。不要冷冻,以免损坏预装的稀释剂注射器。
3)Altuviiio可在不超过30℃的室温下储存一段时间,最长可达6个月。如果储存在室温下,请在纸箱上记录Altuviiio从冰箱中取出的日期。在室温下储存后,不要将产品放回冰箱。
4)请勿在药瓶上印刷的过期日期后,或在纸箱上书写的日期后6个月内使用,这两个时间以较早者为准。
2、复溶后
1)复溶产品可在不超过30℃的室温下储存长达3小时。避免阳光直射。复溶后,如果产品未在3小时内使用,必须丢弃。
2)如果重新配制的溶液混浊或有颗粒物质,请勿使用Altuviiio。
3)丢弃任何未使用的Altuviiio。
【Altuviiio(Efanesoctocog alfa)适应症】
1.适应症
Altuviiio是一种不依赖于血管性血友病因子(VWF)的重组DNA衍生的因子VIII浓缩物,适用于血友病A(先天性因子VIII缺乏症)的成人和儿童:常规预防以减少出血事件的频率;按需治疗和控制出血事件;出血的围手术期管理。
2.使用限制
Altuviiio不适用于治疗血管性血友病。
【Altuviiio(Efanesoctocog alfa)推荐剂量和给药方法】
仅用于复溶后的静脉注射。
一、 建议用量
1)每个Altuviiio药瓶标签都以国际单位(IU)标明了因子VIII的效力。一个国际单位相当于一毫升正常人血浆中所含的因子VIII活性,如当前世界卫生组织因子VIII浓缩物国际标准所定义的。
2)使用基于活化部分凝血活酶时间(aPTT)的一阶段凝血试验确定Altuviiio的效价分配。建议使用经过验证的一步凝血试验来测量血浆中的Altuviiio因子VIII活性。在一阶段凝血分析中,显色分析和特定鞣花酸基aPTT试剂将Altuviiio因子VIII活性水平高估了约2.5倍。
3)对于50 IU/kg的剂量,因子VIII水平的预期体内峰值增加用IU/dL(或正常的百分比)表示,使用以下公式估算:因子VIII的估计增加量(IU/dL或正常的百分比)= 50IU/kg×2(IU/dL/IU/kg)。
4)为了达到特定的目标因子VIII活性水平,使用以下公式:剂量(IU) =体重(kg)×所需的因子VIII增加量(IU/dL或正常的百分比)×0.5(IU/kg/IU/dL)。
5)常规预防:成人和儿童常规预防推荐剂量为50 IU/kg Altuviiio,每周一次。
表1中提供了用于按需治疗和控制出血事件的Altuviiio剂量
对于出血治疗后的预防用药恢复(如适用),建议出血治疗的最后50 IU/kg剂量与恢复预防用药之间至少间隔72小时。此后,可以照常按照患者的常规计划继续进行预防。
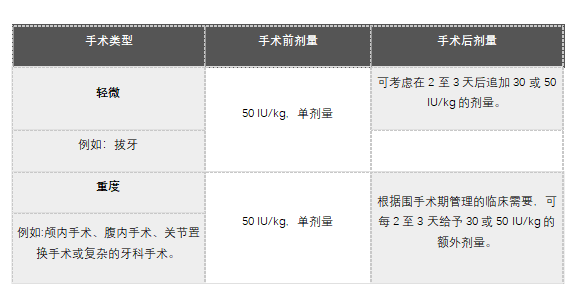
围手术期管理:用于围手术期管理的Altuviiio剂量见表2。
表2:围手术期管理的剂量
二、 制备和复溶
1、在复溶过程中使用无菌技术。
2、在使用前,让含有白色至灰白色冻干粉的Altuviiio小瓶和预填充的稀释剂注射器达到室温。
3、取下Altuviiio药瓶上的塑料盖,用酒精抹布擦拭药瓶的橡皮塞。让橡皮塞变干。
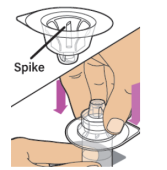
4、揭下盖子,从样品瓶适配器包装上完全取下背衬。请勿从包装中取出药瓶适配器或触摸适配器包装的内部。
5、将小瓶放在平坦的表面上。用一只手握住药瓶,用另一只手将药瓶适配器放在药瓶上方的包装中。长钉应该放在橡皮塞中心的正上方。垂直向下推动药瓶适配器,直到药瓶适配器上的针头刺穿瓶塞的中心并完全插入。
6、从样品瓶适配器上取下包装盖,并扔掉包装盖。
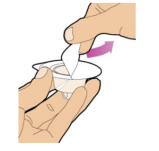
7、仅使用提供的预填充稀释剂注射器来重新配制粉末药物。握住圆盘上的柱塞杆。将柱塞杆的尖端放入预装稀释剂注射器的末端。向右转动柱塞杆,直至其牢固连接。

8、用一只手将预装的稀释剂注射器直接握在盖子下面,使盖子朝上。确保您正拿着预充式稀释剂注射器,握住盖子正下方的隆起部分。如果盖子已经取下或没有固定好,请不要使用。
9、用另一只手抓住盖子,将其弯曲90度,直至其折断。在盖子扣上后,您将会看到预装稀释剂注射器的玻璃头。不要触摸预装稀释剂注射器的玻璃头或盖子的内部。
10、确保小瓶放在平坦的表面上。将预装稀释剂注射器的尖端插入样品瓶适配器开口。向右转动预装稀释剂注射器,直到它牢固地连接到样品瓶适配器上。
11、缓慢向下推动柱塞杆,将预装稀释剂注射器中的所有液体(稀释剂)注入小瓶。柱塞杆随后可能会稍微上升。
12、在预装稀释剂注射器仍与适配器连接的情况下,轻轻旋转小瓶,直到粉末完全溶解。通过小瓶检查溶液,确保粉末完全溶解。该溶液应该看起来清澈,无色至乳白色。不要摇晃。
13、如果复溶的Altuviiio含有可见颗粒或混浊,请勿使用。
14、汇集:汇集是将两个或多个复溶小瓶合并到一个更大的鲁尔锁注射器(纸箱中未提供)中的过程。如果该剂量需要一个以上的小瓶,用提供的预装稀释剂注射器按上述方法(见步骤3-12)重新配制每个小瓶。在准备好将大型鲁尔锁注射器连接到下一个样品瓶之前,不要拆下预装的稀释剂注射器。保持小瓶适配器连接在小瓶上,因为您将需要它来连接大型luer lock注射器。使用较大的luer lock塑料注射器将复溶小瓶的内容物混合到注射器中,类似于步骤13-14中所述。对您将使用的每个样品瓶重复此汇集程序。一旦您汇集了所需的剂量,使用较大的luer lock注射器继续进行给药步骤。
15、确保柱塞杆被完全按下,并且稀释剂注射器牢固地连接到样品瓶适配器上。将小瓶倒置。慢慢拉下柱塞杆,将小瓶中的所有溶液吸入稀释剂注射器。小心不要将柱塞杆完全拉出稀释剂注射器。
16、向右转动稀释剂注射器,轻轻将其从样品瓶适配器上拧下。丢弃仍连接着适配器的小瓶。如果您没有准备好注射,请小心地将注射器盖子放回注射器尖端。不要触摸注射器尖端或盖子内部。
17、尽快使用复溶的Altuviiio,但不迟于复溶后3小时。如果复溶后没有立即使用,请勿触摸注射器的玻璃头。避免阳光直射。复溶后不要冷藏。
三、给药
仅供静脉注射使用。
只要溶液和容器允许,注射用药品在给药前应目视检查是否有颗粒物质和变色。如果观察到颗粒物质或变色,不要使用Altuviiio溶液。不要将复溶的Altuviiio与其他药物放在同一个管道或容器中。
四、给药步骤
1、将注射器向右旋转,直至牢固连接,将其连接到输注装置导管的连接器端。
2、推动柱塞杆,直到排出注射器中的所有空气,并且Altuviiio已充满输液器针头。不要通过针头注射Altuviiio溶液。
3、从输液器针头上取下针头保护罩。
4、进行静脉注射。给药速度应由患者的舒适度决定,且不得快于:成人和青少年:每瓶1-2分钟。儿童:如果体重大于或等于20公斤,每瓶2-3分钟;如果体重小于20公斤,每瓶6分钟。
5、输注Altuviiio后,取出并正确丢弃输液器。
【Altuviiio(Efanesoctocog alfa)警告和注意事项】
一、 过敏反应
Altuviiio可能出现过敏型超敏反应,包括过敏反应。临床试验中未报告过敏型超敏反应。告知患者可能发展为过敏反应的7种过敏反应迹象(包括荨麻疹、气短、胸闷、喘息、低血压和瘙痒)。如果出现过敏症状,建议患者停止使用Altuviiio,并联系医生。
二、 中和抗体
服用Altuviiio后,可能形成因子VIII的中和抗体(抑制剂)。临床试验中没有报道中和抗体。通过适当的临床观察和实验室检查,监测所有患者的凝血因子ⅷ抑制剂的发展。如果患者的血浆因子ⅷ水平未能如预期的那样升高,或者如果服用Altuviiio后出血未得到控制,则应怀疑存在抑制剂(中和抗体),并进行适当的检测。
三、 监控实验室测试
如果需要评估血浆因子VIII的活性,建议使用经过验证的单阶段凝血试验。在一步凝血试验中,显色试验和基于特定鞣花酸的aPTT试剂将Altuviiio因子VIII的活性水平高估了大约2.5倍。如果使用这些分析,将结果除以2.5,以近似患者的Altuviiio因子VIII活性水平。当当地没有合格的一步凝血分析或显色分析时,建议使用参考实验室。监测因子ⅷ抑制剂的发展。如果使用Altuviiio未能控制出血,并且未达到预期的凝血因子VIII活性血浆水平,则进行检测以确定是否存在凝血因子VIII抑制剂(使用Bethesda单位对抑制剂进行滴定)。
【Altuviiio(Efanesoctocog alfa)禁忌症】
对本品或其辅料有严重过敏反应(包括过敏反应)的患者禁用Altuviiio。
【Altuviiio(Efanesoctocog alfa)药物相互作用】
无相关信息。
【Altuviiio(Efanesoctocog alfa)不良反应】
1、Altuviiio可能会导致严重的副作用,包括:荨麻疹、呼吸困难、面部、嘴唇、舌头或喉咙肿胀、皮疹、麻木、刺痛、发热、头晕、恶心、心跳加快、胸闷、喘息、皮肤苍白、冷汗、头晕、昏厥、出血次数增加、任何无法停止的出血和胸痛。如果您有上述任何症状,请立即就医。
2、Altuviiio最常见的副作用包括:鼻出血、恶心、呕吐、腹泻、头痛、头晕、肌肉或关节痛、皮疹、脸红(突然发热、发红或有刺痛感)、发烧、发冷、咳嗽、虚弱以及注射部位疼痛、肿胀、瘙痒或发红。
【Altuviiio(Efanesoctocog alfa)在特殊人群中使用】
1、妊娠
没有数据表明孕妇使用Altuviiio会导致药物相关风险。尚未使用Altuviiio进行动物发育和生殖研究。因此,Altuviiio在给孕妇使用时是否会影响生殖能力或对胎儿造成伤害还不得而知。
2、哺乳期
没有关于母乳中存在Altuviiio、其对母乳喂养婴儿的影响或其对泌乳量的影响的信息。母乳喂养的发育和健康益处应与母亲对Altuviiio的临床需求以及Altuviiio或潜在母体疾病对母乳喂养婴儿的任何潜在不利影响一起考虑。
3、儿科用药
作为常规预防、出血事件治疗或围手术期管理的一部分,接受至少一剂Altuviiio的18岁以下儿科患者。青少年受试者参加成人和青少年研究,12岁以下的儿科受试者参加正在进行的儿科试验。31名受试者(33.7%)年龄小于6岁,36名受试者(39.1%)年龄为6至< 12岁,25名受试者(27.2%)为青少年(12至< 18岁)。一项针对67名12岁以下受试者的儿科研究的中期数据显示,无需调整剂量。
4、老年用药
Altuviiio的临床研究没有纳入足够数量的65岁及以上受试者,以确定他们的反应是否与年轻受试者不同。然而,其他因子VIII产品的临床经验并未发现老年患者和年轻患者之间的差异。
【Altuviiio(Efanesoctocog alfa)一般描述】
Altuviiio是一种无菌、无热原、白色至灰白色冻干粉,用于静脉注射。该产品以单剂量小瓶提供,标称效价为250、500、750、1000、2000、3000或4000国际单位(IU)。每瓶Altuviiio都标有以IU为单位的实际因子VIII活性含量。注射用粉末用3 mL无菌注射用水复溶,该注射用水在无菌预充式注射器中提供。复溶的溶液应该基本上没有颗粒。
最终产品包含赋形剂:精氨酸盐酸盐(250 mM)、氯化钙二水合物(5 mM)、组氨酸(10 mM)、聚山梨醇酯80 (0.05% w/v)和蔗糖(5% w/v)。
Altuviiio中的活性成分是一种完全重组的融合蛋白,包含共价融合到人免疫球蛋白G1 (IgG1)的Fc结构域、人血管性血友病因子(VWF)的FVIII结合D’D3结构域和2个XTEN多肽的人FVIII的单链B结构域缺失(BDD)类似物。Altuviiio含有2829个氨基酸,表观分子量为312 kDa。Altuviiio被合成为由2个Fc铰链二硫键共价连接的2条多肽链。第一个FVIII-XTEN-Fc多肽链包含FVIII的A1A2结构域以及来自B结构域(1745个氨基酸)的5个氨基酸,融合到288-XTEN多肽(代替天然的FVIII B结构域)、FVIII的A3C1C2结构域(1649-2332)和人IgG1的Fc结构域。第二条VWF-XTEN-a2-Fc多肽链包含与144-XTEN多肽融合的VWF的D’D3结构域(1-477个氨基酸),来自FVIII的凝血酶可裂解的酸性区2序列和人IgG1的Fc结构域。Fc结构域包括IgG1的铰链区、CH2和CH3结构域。该分子的Fc、VWF和XTEN部分延长了Altuviiio在血浆中的半衰期。
Altuviiio是通过重组DNA技术在人胚胎肾(HEK)细胞系中产生的,该细胞系已被广泛表征。Altuviiio是在不添加人或动物来源的成分的情况下制造的,并通过多个色谱步骤、去污剂病毒灭活步骤、用于病毒清除的纳滤步骤和超滤步骤的组合来纯化。
【Altuviiio(Efanesoctocog alfa)作用机制】
Altuviiio暂时替代有效止血所需的缺失的凝血因子VIII。Altuviiio的半衰期相对于其他标准和延长半衰期的FVIII产品延长了3至4倍。
【Altuviiio(Efanesoctocog alfa)患者资讯资料】
1、如果患者对因子VIII治疗缺乏临床反应,请联系医生进行进一步治疗和/或评估,因为这可能是产生中和抗体的迹象。
2、如果出现过敏反应,立即前往急诊科。过敏反应的早期迹象可能包括皮疹、荨麻疹、瘙痒、面部肿胀、胸闷和喘息。
信息来源:
[1]https://www.rxlist.com/Altuviiio-drug.htm#warnings
注:药品如有新包装,以新包装为准。以上资讯为高等医药院校的学生志愿者翻译(如有错漏,请帮忙指正),仅供医护人员内部讨论,不作任何用药依据,具体用药指引,请咨询主治医师。
如您发现本网站有文字编辑或内容错误,请点击此处发送(需要安装有foxmail或outlook支持),
或发邮件至:info@pidrug.com,香港济民药业感谢您的到访!
欢迎您添加香港济民药业微信,或在公众号内留言。